Butaan
 From Wikipedia (Af) - Reading time: 5 min
From Wikipedia (Af) - Reading time: 5 min
|
Algemeen | |
|---|---|
| Naam | Butaan |
| IUSTC-naam | Butaan[1] |
| Sistematiese naam | Tetrakarbaan (nooit aanbeveel nie)[1] |
| Ander name | Butielhidried[2] Kwartaan[3] Koelmiddel 3-11-0 |
 |
 |
| Chemiese formule | C4H10 |
| Molêre massa | 58,124 g/mol |
| CAS-nommer | 106-97-8 |
| Voorkoms | kleurlose gas |
| Reuk | Petrolagtige of natuurlike gasagtige[2] |
| Fasegedrag | |
| Smeltpunt | -140 tot -134 °C |
| Kookpunt | -1 tot 1 °C |
| Digtheid | 2,48 kg/m3 (teen 15 °C) |
| Oplosbaarheid | 61 mg/L (teen 20 °C in water) |
|
Suur-basis eienskappe | |
| pKa | |
|
Veiligheid | |
| Flitspunt | −60 °C |
| Selfontbrandingspunt | 405 °C |
|
Tensy anders vermeld is alle data vir standaardtemperatuur en -druk toestande. | |
| Portaal | |
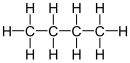
Butaan of n-butaan is 'n alkaan met die formule C4H10. Butaan is 'n gas teen kamertemperatuur en atmosferiese druk. Butaan is 'n baie vlambare, kleurlose, maklik vloeibare gas wat vinnig verdamp teen kamertemperatuur. Die naam butaan is afkomstig van die Griekse woord vir botter (en bottersuur). Dit is in 1849 deur die chemikus Edward Frankland ontdek.[4] In 1864 het Edmund Ronalds dit vir die eerste keer opgelos in ruwe petroleum gevind en hy het die eienskappe daarvan beskryf.[5][6]
Isomere en konformasies
[wysig | wysig bron]Butaan kom in twee vorms voor, n-butaan en i-butaan.
| Algemene naam | normale butaan onvertakde butaan n-butaan |
isobutaan i-butaan |
| IUSTC-naam | butaan | metielpropaan |
| Molekulêre diagram |

|

|
| Skelet diagram |

|
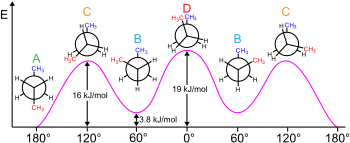
Rotasie om die sentrale C−C binding in n-butaan lei tot verskillende konformasies (trans, cis en gauche).[7]
Reaksies
[wysig | wysig bron]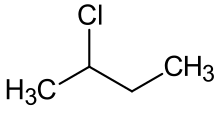
Wanneer daar 'n oormaat suurstof is, brand butaan om koolstofdioksied en waterdamp te vorm; as suurstof beperk is, kan koolstof (roet) of koolstofmonoksied ook gevorm word. Butaan is digter as lug.
As daar voldoende suurstof is:
- 2 C4H10 + 13 O2 → 8 CO2 + 10 H2O
Wanneer suurstof beperk is:
- 2 C4H10 + 9 O2 → 8 CO + 10 H2O
n-Butaan, soos alle koolwaterstowwe, ondergaan vrye radikale chloorering, wat beide 1-chloor- en 2-chloorbutaan vorm, asook meer gechloreerde derivate.
Gebruike
[wysig | wysig bron]
Normale butaan kan gebruik word in die vermenging met petrol, as 'n brandstofgas, oplosmiddel vir geurekstraksie, hetsy alleen of in 'n mengsel met propaan, en as bronmateriaal vir die vervaardiging van etileen en butadieen, 'n belangrike bestanddeel van sintetiese rubber. Isobutaan word hoofsaaklik deur raffinaderye gebruik om die oktaangetal van petrol te vergroot. Baie suiwer vorms van butaan, veral isobutaan, kan as koelmiddels gebruik word en het die osoonlaag-afbrekende halometaan hoofsaaklik vervang, in huishoudelike yskaste en vrieskaste, ens. Butaan word ook gebruik as brandstof vir 'n sigaretteaanstekers of butaan fakkel en word in bottels verkoop as brandstof vir kook of braai en vir kampeerstowe.[10]
As brandstof word dit dikwels gemeng met klein hoeveelhede waterstofsulfied en merkaptane wat die onverbrande gas 'n aanstootlike reuk gee wat maklik deur die menslike neus opgespoor kan word. Op hierdie manier kan butaanlekkasies maklik geïdentifiseer word. Terwyl waterstofsulfied en merkaptane giftig is, is dit teenwoordig in vlakke wat so laag is dat versmoring en brandgevaar deur die butaan meer waarskynlik is as toksisiteit.[11][12] Die meeste kommersieel beskikbare butaan bevat ook 'n sekere hoeveelheid besoedelingsolie wat deur filtrasie verwyder kan word, maar wat andersins 'n neerslag op die punt van ontbranding sal lewer en uiteindelik die eenvormige gasstroom kan blokkeer.[13] Die butaan wat gebruik word by die ontginning van geure bevat nie hierdie besoedelingstowwe nie[14] en die butaangas kan gasontploffings in swak geventileerde gebiede veroorsaak as lekkasies ongesiens bly en deur vonk of vlam aangesteek word.[15]
Verwysings
[wysig | wysig bron]- ↑ 1,0 1,1 "Front Matter". Nomenclature of Organic Chemistry : IUPAC Recommendations and Preferred Names 2013 (Blue Book) (in Engels). Cambridge: Royal Society of Chemistry. 2014. p. 4. doi:10.1039/9781849733069-FP001. ISBN 978-0-85404-182-4.
Net so is die behoue name 'etaan', 'propaan', en 'butaan' nooit deur sistematiese name 'dikarbaan', 'trikarbaan', and 'tetrkarbaan' vervang nie, soos aanbeveel was vir analoë van silaan, 'disilaan'; fosfaan, 'trifosfaan'; en sulfaan, 'tetrasulfaan'.
- ↑ 2,0 2,1 "NIOSH Pocket Guide to Chemical Hazards - n-Butane". CDC (in Engels). 30 Oktober 2019. Besoek op 22 Maart 2021.
- ↑ von Hofmann, August Wilhelm (1 Januarie 1867). "I. On the action of trichloride of phosphorus on the salts of the aromatic monamines". Proceedings of the Royal Society of London (in Engels). 15: 54–62. doi:10.1098/rspl.1866.0018. S2CID 98496840.
- ↑ Russel, Colin A. (20 Maart 2009). "Frankland - the First Organometallic Chemist" (PDF). The Sixth Wheeler Lecture (in Engels). Royal Society of Chemistry. Geargiveer vanaf die oorspronklike (PDF) op 17 April 2017.
- ↑ Watts, H.; Muir, M.M.P.; Morley, H.F. (1894). Watts' Dictionary of Chemistry. Watts' Dictionary of Chemistry (in Engels). Longmans, Green. p. 385.
- ↑ Maybery, C.F. (1896). "On the Composition of the Ohio and Canadian Sulphur Petroleums". Proceedings of the American Academy of Arts and Sciences (in Engels). 31: 1–66. doi:10.2307/20020618. JSTOR 20020618.
- ↑ Balabin, Roman M. (2009). "Enthalpy Difference between Conformations of Normal Alkanes: Raman Spectroscopy Study of n-Pentane and n-Butane". J. Phys. Chem. A (in Engels). 113 (6): 1012–9. doi:10.1021/jp809639s. PMID 19152252.
- ↑ McMurry, J (2012). Organic chemistry (in Engels) (8 uitg.). Belmont, CA: Brooks/Cole. p. 98. ISBN 9780840054449.
- ↑ Moss, GP (1 Januarie 1996). "Basic terminology of stereochemistry (IUPAC Recommendations 1996)". Pure and Applied Chemistry (in Engels). 68 (12): 2193–2222. doi:10.1351/pac199668122193. ISSN 1365-3075. S2CID 98272391.
- ↑ "Butane" (in Engels). Government of Western Australia Mental Health Commission. Besoek op 22 Maart 2021.
- ↑ Gresham, Chip (16 November 2019). "Hydrogen Sulfide Toxicity: Practice Essentials, Pathophysiology, Etiology". Medscape Reference (in Engels). Besoek op 22 Maart 2021.
- ↑ Committee on Acute Exposure Guideline Levels; Committee on Toxicology; Board on Environmental Studies and Toxicology; Division on Earth and Life Studies; National Reserch Council (26 September 2013). 2. Methyl Mercaptan Acute Exposure Guideline Levels.
{{cite book}}:|website=ignored (hulp)AS1-onderhoud: meer as een naam (link) - ↑ "BHO Mystery Oil". Skunk Pharm Research (in Engels). 26 Augustus 2013. Besoek op 22 Maart 2021.
- ↑ "Final Report of the Safety Assessment of Isobutane, Isopentane, n-Butane, and Propane". Journal of the American College of Toxicology (in Engels). SAGE Publications. 1 (4): 127–142. 1982. doi:10.3109/10915818209021266. ISSN 0730-0913.
- ↑ "Safety Data Sheet, Material Name: n-Butane" (PDF) (in Engels). Matheson Tri-Gas Incorporated. 5 Februarie 2011. Geargiveer vanaf die oorspronklike (PDF) op 1 Oktober 2011. Besoek op 22 Maart 2021.
 KSF
KSF