Prion
 From Wikipedia (Af) - Reading time: 7 min
From Wikipedia (Af) - Reading time: 7 min
| Prionsiektes | |
|---|---|
 |
'n Prion is 'n foutiewelik gevoude proteïen wat oor die vermoë beskik om die foutiewelik gevoude vorm daarvan op of na normale variasies van dieselfde proteïen te transmitteer. Die proteïene kom voor by verskeie noodlottige en oordraagbare neuro-degeneratiewe siektes in mense en ander diere.[1] Die oorsaak van die proteïen se foutiewelike invouing is nie bekend nie, maar daar word vermoed dat die abnormale tersiêre (driedimensionele) Proteïenstruktuur aansteeklike eienskappe oordra, wat nabygeleë proteïenmolekules in dieselfde vorm laat invou. Die woord prion kom van "proteïnase aansteeklike deeltjie".[2][3][4] Die veronderstelde rol van 'n proteïen as 'n aansteeklike agent staan in kontras met alle ander bekende aansteeklike agente soos virusse, bakterieë, swamme en parasiete, wat almal nukliënsure bevat (DNS, RNS of albei).
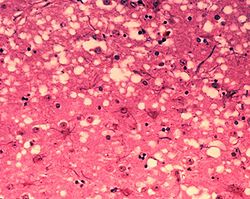
Prion variante van die prionproteïen (PrP), waarvan die spesifieke funksie onseker is, word voorgehou as die oorsaak van oordraagbare sponsagtige enkefalopatie (TSEs),[5] insluitende scrapie in skape, Sponsagtige beesenkefalopatie (BSE) in beeste (algemeen bekend as "malkoeisiekte") en Creutzfeldt–Jakob-siekte (CJD) in mense. Alle bekende prionsiektes in soogdiere affekteer die struktuur van die brein of ander neurale weefsel; almal is progressief, met geen bekende effektiewe behandeling nie en altyd dodelik.[6] Tot 2015 is gedink dat alle bekende prion-siektes wat soogdiere affekteer veroorsaak word deur die prion-proteïen (PrP); In 2015 is daar egter gevind dat veelvuldige stelselatrofie (MSA) oordraagbaar is en is daar voorgestel dat dit veroorsaak word deur 'n prionvorm van alfa-synukleïn.
'n Prion vorm abnormale opeenhopings proteïene wat amiloiëde genoem word, en wat versamel in geïnfekteerde weefsel en geassosieer word met weefselskade en selsterftes.[7] Amiloïde is ook verantwoordelik vir verskeie ander senuwee-degeneratiewe siektes soos Alzheimer se siekte en Parkinson se siekte.[8] Prion opeenhopings is stabiel, en hierdie strukturele stabiliteit beteken dat prione weerstandig is teen denaturasie deur chemiese en fisiese stowwe: dit kan nie vernietig word deur gewone disinfeksie of die kook daarvan nie. Dit bemoeilik die verwydering van hierdie deeltjies.
'n Prionsiekte is 'n tipe proteopatie, of siekte van struktureel abnormale proteïene. Daar word geglo dat 'n prion in mense die oorsaak is van Creutzfeldt–Jakob-siekte (CJD), die variant daarvan (vCJD), Gerstmann–Sträussler–Scheinker sindroom (GSS), noodlottige slaaploosheid (FFI) en die kuru siekte.[2] Daar bestaan ook bewyse wat suggereer dat prione 'n rol speel in die proses van Alzheimer se siekte, Parkinson se siekte en amiotropiese laterale sklerose (ALS), en die term prion-tipe siektes word al aan die siektes toegedeel.[9][10][11][12] Verskeie gisproteïene is ook geïdentifiseer wat beskik oor prion-genetiese eienskappe. Prion kopiëring is net soos ander vorme van kopiëring onderhewig aan epimutasie en natuurlike seleksie, en die struktuur daarvan verskil effens tussen spesies. [13]
Prion proteïen
[wysig | wysig bron]Ontdekking
[wysig | wysig bron]In the 1950's het Daniel Carleton Gajdusek met navorsing begin wat uiteindelik getoon het dat kuru oorgedra kan word na Sjimpansee deur middel van wat moontlik 'n nuwe aansteeklike medium of middel kon wees. Hy het uiteindelik vir dié werk in 1976 die Nobelprys gewen. Gedurende die 1960's het twee Londense navorsers, die bestralingsbioloog Tikvah Alper en die biofisikus John Stanley Griffith, die hipotese ontwikkel dat die Aansteeklike sponsagtige enkefalopatie veroorsaak word deur 'n aansteeklike middel wat geheel en al uit proteïene bestaan.[14][15] Vroeëre ondersoeke deur E.J. Field na scrapie en kuru het bewyse gevind ten opsigte van die oordrag van patologies onbeweeglike polisakkariede wat slegs aansteeklik word na oordrag in die nuwe gasheer.[16][17] Alper en Griffith wou 'n verklaring bied vir die ontdekking dat die geheimsinnige aansteeklike middel, wat scrapie en Creutzfeldt–Jakob-siekte versprei, ioniserende bestraling kon weerstaan.[18] Griffith het drie maniere voorgestel waarop 'n proteïen 'n patogeen kan wees.[19]
In die eerste hipotese het hy voorgestel dat indien die proteïen die produk is van 'n normaal-onderdrukte geen - en die invoer van die proteïen die uitdrukking van die geen kan veroorsaak, dit wil sê, die slapende geen kan aanwakker - die resultaat 'n proses sou wees wat nie van kopiëring onderskei kan word nie, aangesien die uitdrukking van die geen die proteïen sou produseer, wat dan die gene in ander selle sou opwek.
Sy tweede hipotese vorm die basis van moderne prion-teorie, en stel voor dat 'n abnormale vorm van 'n sellulêre proteïen 'n normale proteïen van dieselfde tipe na sy abnormale vorm kan omskakel, en sodoende tot kopiëring kan lei. Sy derde hipotese stel voor dat die middel 'n teenliggaam kan wees indien die teenliggaam sy eie teiken antigeen is, aangesien so 'n teenliggaam daartoe sal lei dat al hoe meer teenliggame teen homself geproduseer word. Griffith het egter erken dat hierdie derde hipotese waarskynlik nie korrek was nie, as gevolg van die gebrek aan 'n waarneembare immuunrespons.[20]
Francis Crick het die potensiële belang van die Griffith "proteïen-slegs-hipotese" vir skrapie-voortplanting in die tweede uitgawe van sy "Central dogma of molecular biology" (1970) erken: Terwyl hy beweer dat die vloei van sekwensie-inligting van proteïen na proteïen, of van proteïene aan RNS en DNS "uitgesluit" is, het hy opgemerk dat Griffith se hipotese 'n moontlike teenstrydigheid was (alhoewel dit nie so deur Griffith aangevoer is nie).[21] Die hersiene hipotese is later deels geformuleer om omgekeerde transkripsie te akkommodeer (wat Howard Martin Temin en David Baltimore in 1970 ontdek het).[22]
In 1982 het Stanley B. Prusiner van die Universiteit van Kalifornië, San Francisco, aangekondig dat sy span die hipotetiese aansteeklike proteïen gesuiwer het, ten opsigte waarvan dit wou voorkom of dit nie in gesonde gashere teenwoordig is nie, alhoewel hulle tot twee jaar na die aankondiging van Prusiner nie daarin kon slaag nie om die proteïen te isoleer.[23][24] Die proteïen is 'n prion genoem, vir "Proteïnase aansteeklike deeltjie", afgelei van die woorde proteïen en infeksie (infection). Toe die prion ontdek is, is Griffith se eerste hipotese naamlik, dat die proteïen die produk van 'n normaalweg stille geen was, deur baie verkies. Dit is egter daarna ontdek dat dieselfde proteïen in normale gashere, maar in 'n verskillende vorm, bestaan.[25]
Na die ontdekking van dieselfde proteïen in verskillende vorme by onbesmette individue is die spesifieke proteïen waaruit die prion saamgestel is die Prion Proteïen (PrP) genoem. Griffith se tweede hipotese naamlik; dat 'n abnormale vorm van 'n gasheerproteïen ander proteïene van die dieselfde tipe na die proteïene se abnormale vorm kan omskakel; het die dominante teorie geword.[20] Prusiner het in 1997 die Nobelprys vir Geneeskunde gewen vir sy navorsing oor die prion.[26]
Verwysings
[wysig | wysig bron]- ↑ "Prion diseases". Diseases and conditions (in Engels). National Institute of Health. Geargiveer vanaf die oorspronklike op 22 Mei 2020.
- ↑ 2,0 2,1 "Prion diseases" (in Engels). United States Centers for Disease Control and Prevention. 3 Mei 2019. Geargiveer vanaf die oorspronklike op 18 Mei 2020.
- ↑ "What Is a Prion?". Scientific American. Besoek op 15 Mei 2018.
- ↑ "Prion infectious agent"..
- ↑ Prusiner SB (Junie 1991). "Molecular biology of prion diseases". Science. 252 (5012): 1515–22. Bibcode:1991Sci...252.1515P. doi:10.1126/science.1675487. PMID 1675487.
- ↑ Prusiner SB (November 1998). "Prions". Proceedings of the National Academy of Sciences of the United States of America. 95 (23): 13363–83. Bibcode:1998PNAS...9513363P. doi:10.1073/pnas.95.23.13363. PMC 33918. PMID 9811807.
- ↑ Dobson CM (Februarie 2001). "The structural basis of protein folding and its links with human disease". Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 356 (1406): 133–45. doi:10.1098/rstb.2000.0758. PMC 1088418. PMID 11260793.
- ↑ Irvine GB, El-Agnaf OM, Shankar GM, Walsh DM (2008). "Protein aggregation in the brain: the molecular basis for Alzheimer's and Parkinson's diseases". Molecular Medicine. 14 (7–8): 451–64. doi:10.2119/2007-00100.Irvine. PMC 2274891. PMID 18368143.
- ↑ Laurén J, Gimbel DA, Nygaard HB, Gilbert JW, Strittmatter SM (Februarie 2009). "Cellular prion protein mediates impairment of synaptic plasticity by amyloid-beta oligomers". Nature. 457 (7233): 1128–32. Bibcode:2009Natur.457.1128L. doi:10.1038/nature07761. PMC 2748841. PMID 19242475.
- ↑ Olanow, CW; Brundin, P (Januarie 2013). "Parkinson's disease and alpha synuclein: is Parkinson's disease a prion-like disorder?". Movement Disorders. 28 (1): 31–40. doi:10.1002/mds.25373. PMID 23390095.
- ↑ Goedert, M (7 Augustus 2015). "Neurodegeneration: Alzheimer's and Parkinson's diseases: The prion concept in relation to assembled Aβ, tau, and α-synuclein". Science. 349 (6248): 1255555. doi:10.1126/science.1255555. PMID 26250687.
- ↑ Shynrye Lee; Hyung-Jun Kim (17 Desember 2014). "Prion-like Mechanism in Amyotrophic Lateral Sclerosis: are Protein Aggregates the Key?". Experimental Neurobiology. 24 (1): 1–7. doi:10.5607/en.2015.24.1.1. PMC 4363329. PMID 25792864.
- ↑ Li J, Browning S, Mahal SP, Oelschlegel AM, Weissmann C (Februarie 2010). "Darwinian evolution of prions in cell culture". Science. 327 (5967): 869–72. Bibcode:2010Sci...327..869L. doi:10.1126/science.1183218. PMC 2848070. PMID 20044542.
{{cite journal}}: Eksterne skakel in|lay-url=|lay-url=geïgnoreer (hulp); Onbekende parameter|laydate=geïgnoreer (hulp); Onbekende parameter|laysource=geïgnoreer (hulp) - ↑ Alper T, Cramp WA, Haig DA, Clarke MC (Mei 1967). "Does the agent of scrapie replicate without nucleic acid?". Nature. 214 (5090): 764–66. Bibcode:1967Natur.214..764A. doi:10.1038/214764a0. PMID 4963878.
- ↑ Griffith JS (September 1967). "Self-replication and scrapie". Nature. 215 (5105): 1043–44. Bibcode:1967Natur.215.1043G. doi:10.1038/2151043a0. PMID 4964084.
- ↑ Field EJ (September 1966). "Transmission experiments with multiple sclerosis: an interim report". British Medical Journal. 2 (5513): 564–65. doi:10.1136/bmj.2.5513.564. PMC 1943767. PMID 5950508.
- ↑ Adams DH, Field EJ (September 1968). "The infective process in scrapie". Lancet. 2 (7570): 714–16. doi:10.1016/s0140-6736(68)90754-x. PMID 4175093.
- ↑ Field EJ, Farmer F, Caspary EA, Joyce G (April 1969). "Susceptibility of scrapie agent to ionizing radiation". Nature. 5188. 222 (5188): 90–91. Bibcode:1969Natur.222...90F. doi:10.1038/222090a0. PMID 4975649.
- ↑ Griffith JS (September 1967). "Self-replication and scrapie". Nature. 215 (5105): 1043–4. Bibcode:1967Natur.215.1043G. doi:10.1038/2151043a0. PMID 4964084.
- ↑ 20,0 20,1 Bolton, David (1 Januarie 2004). Prions, the Protein Hypothesis, and Scientific Revolutions. pp. 21–60 – via ResearchGate.
- ↑ Crick F (Augustus 1970). "Central dogma of molecular biology". Nature. 227 (5258): 561–63. Bibcode:1970Natur.227..561C. doi:10.1038/227561a0. PMID 4913914.
- ↑ Coffin JM, Fan H (September 2016). "The Discovery of Reverse Transcriptase". Annual Review of Virology. 3 (1): 29–51. doi:10.1146/annurev-virology-110615-035556. PMID 27482900.
- ↑ Taubes, Gary (Desember 1986). "The game of name is fame. But is it science?". Discover. 7 (12): 28–41.
{{cite journal}}: Onbekende parameter|name-list-format=geïgnoreer (hulp) - ↑ Prusiner SB (April 1982). "Novel proteinaceous infectious particles cause scrapie". Science. 216 (4542): 136–44. Bibcode:1982Sci...216..136P. doi:10.1126/science.6801762. PMID 6801762.
- ↑ Atkinson CJ, Zhang K, Munn AL, Wiegmans A, Wei MQ (2016). "Prion protein scrapie and the normal cellular prion protein". Prion. 10 (1): 63–82. doi:10.1080/19336896.2015.1110293. PMC 4981215. PMID 26645475.
- ↑ "The Nobel Prize in Physiology or Medicine, 1997" (in Engels). NobelPrize.org. Geargiveer vanaf die oorspronklike op 9 Augustus 2018. Besoek op 28 Februarie 2010.
Eksterne skakels
[wysig | wysig bron] Wikimedia Commons het meer media in die kategorie Prion.
Wikimedia Commons het meer media in die kategorie Prion.- CDC – US Center for Disease Control and Prevention – inligting oor prionsiektes
- World Health Organisation – WGO inligting oor prionsiektes
- The UK BSE Inquiry – Report of the UK public inquiry into BSE and variant CJD
- UK Spongiform Encephalopathy Advisory Committee (SEAC)
 KSF
KSF