Sigma-binding
 From Wikipedia (Af) - Reading time: 3 min
From Wikipedia (Af) - Reading time: 3 min

In die chemie is sigma-bindings (σ-bindings) die sterkste tipe kovalente chemiese binding.[1] Dit is as gevolg van die direkte oorvleueling van orbitale, en daar word soms na die elektrone in hierdie bindings verwys as sigma-elektrone.[2]
Die bindings word gevorm deur kop-aan-kop-oorvleueling tussen atoomorbitale en 'n sigma-binding is simmetries ten opsigte van rotasie om die bindingsas.[3] Kwantumteorie dui aan dat molekulêre orbitale met identiese simmetrie eintlik meng of verbaster en die omvang van hierdie vermenging (of verbastering) hang af van die relatiewe energieë van die molekulêre orbitale met dieselfde simmetrie.
Vir molekules met net twee van die selfde atome (bv. H2) het die σ-orbitale wat deelneem aan die binding geen nodale vlakke waarop die golffunksie nul is nie, hetsy tussen die atome of deur die atome. Die ooreenstemmende antibinding-orbitaal, of σ*-orbitaal, word gedefinieer deur die teenwoordigheid van een knooppunt tussen die twee atome.
Gewoonlik is 'n enkele binding 'n sigma-binding, terwyl 'n veelvoudige binding uit een sigma-binding saam met pi- of ander bindings bestaan. 'n Dubbelbinding het een sigma- plus een pi-binding, en 'n drievoudige binding het een sigma- plus twee pi-bindings.
Multi-atoom molekules
[wysig | wysig bron]Sigma-bindings word verkry deur oorvleueling van atoomorbitale. Die konsep van sigma-binding beskryf bindingsinteraksies wat oorvleueling van 'n enkele lob van een orbitaal met 'n enkele lob van 'n ander insluit. Propaan (C3H8) word byvoorbeeld beskryf as bestaande uit tien sigma-bindings, een elk vir die twee C-C bindings en een elk vir die agt C-H bindings.
Veelvuldige verbindings
[wysig | wysig bron]Oorgangsmetaalkomplekse met veelvoudige bindings het sigma-bindings tussen die veelvoudige atome. Hierdie sigma-bindings kan aangevul word met ander bindingsinteraksies, soos donasie van π- of δ-bindings.[4]
Organiese molekules
[wysig | wysig bron]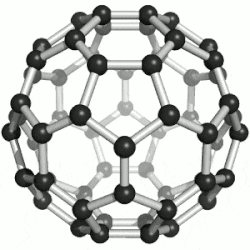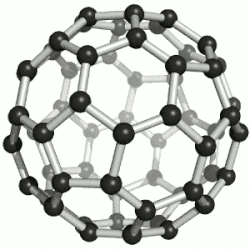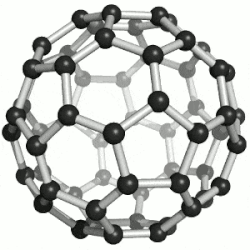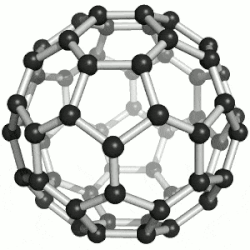
Organiese molekules is dikwels sikliese verbindings wat een of meer ringe bevat, soos benseen, en bestaan dikwels uit baie sigma-bindings tesame met pi-bindings. Volgens die sigma-bindingsreël is die aantal sigma-bindings in 'n molekuul gelyk aan die aantal atome plus die aantal ringe minus een.
- Nσ= Natome + Nringe − 1
Hierdie reël is 'n spesiale toepassing van die Euler-eienskap in wiskunde van die grafiek wat die molekuul voorstel.
'n Molekuul sonder ringe kan voorgestel word as 'n boom met 'n aantal bindings gelyk aan die aantal atome minus een (soos in waterstof, H2, met slegs een sigma-binding, of ammoniak, NH3, met 3 sigma-bindings). Daar is nooit meer as 1 sigma-binding tussen twee atome nie.
Molekules met ringe het addisionele sigma-bindings, soos benseenringe, met 6 C-C sigma-bindings binne die ring vir 6 koolstofatome. Die antraseenmolekule, C14H10, het drie ringe sodat die reël die aantal sigma-bindings as 24 + 3 - 1 = 26 gee. In hierdie geval is daar 16 C-C sigma-bindings en 10 C-H sigma-bindings.
Hierdie reël misluk in die geval van molekules wat, as dit plat op papier geteken is, 'n ander aantal ringe het as wat die molekule eintlik het - byvoorbeeld Buckminsterfullerene, C60, wat 32 ringe, 60 atome en 90 sigma-bindings het, een vir elke paar gebinde atome; maar 60 + 32 - 1 = 91, nie 90 nie.
Kyk ook
[wysig | wysig bron]Verwysings
[wysig | wysig bron]- ↑ Moore, John; Stanitski, Conrad L.; Jurs, Peter C. (21 Januarie 2009). Principles of Chemistry: The Molecular Science (in Engels). ISBN 9780495390794.
- ↑ Keeler, James; Wothers, Peter (Mei 2008). Chemical Structure and Reactivity (in Engels) (1ste uitg.). Oxford: Oxford University Press. pp. 27–46. ISBN 978-0199289301.
- ↑ Clayden, Jonathan; Greeves, Nick; Warren, Stuart (Maart 2012) [2002]. Organic Chemistry (in Engels) (2de uitg.). Oxford: Oxford University Press. pp. 101–136. ISBN 978-0199270293.
- ↑ Kubas, Gregory (2002). "Metal Dihydrogen and σ-Bond Complexes: Structure, Theory, and Reactivity". J. Am. Chem. Soc. 124 (14): 3799–3800. doi:10.1021/ja0153417.
 KSF
KSF