Actina
 From Wikipedia (Es) - Reading time: 59 min
From Wikipedia (Es) - Reading time: 59 min
| Familia: Actinas | ||||||
|---|---|---|---|---|---|---|
| Identificadores | ||||||
| Identificadores externos | ||||||
| ||||||
| Estructura/Función proteica | ||||||
| Tamaño | 230-375 (aminoácidos) | |||||
| Estructura | Globular | |||||
| Funciones |
Citoesqueleto, Unión intercelular, Movimiento | |||||
| Actina | ||
|---|---|---|
| Identificadores | ||
| Símbolo | Actin | |
| PROSITE | PDOC00340 | |
La actina es una familia de proteínas globulares[1] que forman los microfilamentos, uno de los tres componentes fundamentales del citoesqueleto de las células de los organismos eucariotas.
Puede encontrarse como monómero en forma libre, denominada actina G (globular), o como parte de polímeros lineales denominados microfilamentos o actina F, que son esenciales para funciones celulares tan importantes como la movilidad y la contracción de la célula durante la división celular.
De la importancia capital de la actina dan cuenta dos hechos: en el contenido proteico total de una célula, representa siempre un elevado porcentaje y que su secuencia está muy conservada, es decir, que ha cambiado muy poco a lo largo de la evolución.[2][3] Por ambas razones se puede decir que su estructura ha sido optimizada. Sobre esta se pueden destacar dos rasgos peculiares: es una enzima que hidroliza ATP, la «moneda universal de la energía» de los procesos biológicos, haciéndolo muy lentamente. Pero al mismo tiempo necesita de esa molécula para mantener su integridad estructural. Adquiere su forma eficaz en un proceso de plegamiento casi dedicado. Además es la que establece más interacciones con otras proteínas de cuantas se conocen, lo que le permite desempeñar las más variadas funciones que alcanzan a casi todos los aspectos de la vida celular. La miosina es un ejemplo de proteína que une actina. Otro ejemplo es la vilina, que puede entrelazar la actina en haces o bien cortar los filamentos de actina, dependiendo de la concentración de catión calcio en su entorno.[4]
Formando microfilamentos en un proceso dinámico proporciona un andamiaje que dota a la célula de una forma con posibilidad de remodelarse rápidamente en respuesta a su entorno o a señales del organismo, por ejemplo, aumentando la superficie celular para la absorción o proporcionando soporte a la adhesión de las células para formar tejidos. Sobre este andamiaje se pueden anclar otras enzimas, orgánulos como el cilio, dirigir la deformación de la membrana celular externa que permite la ingestión celular o la citocinesis. También puede producir movimiento, bien por ella misma o ayudada de motores moleculares. De ese modo, contribuye a procesos como el transporte intracelular de vesículas y orgánulos y la contracción muscular, o la migración celular, importante en el desarrollo embrionario, reparación de heridas o invasividad del cáncer. El origen evolutivo de esta proteína se puede rastrear en las células procariotas, donde existen equivalentes. Por último, es importante en el control de la expresión génica.
Un buen número de enfermedades tienen como base alteraciones genéticas en alelos de los genes que gobiernan la producción de la actina o de sus proteínas asociadas, siendo también esencial en el proceso de infección de algunos microorganismos patógenos. Las mutaciones en los distintos genes de actina presentes en humanos ocasionan miopatías, variaciones en el tamaño y la función cardíaca y sordera. Los componentes del citoesqueleto también tienen relación con la patogenicidad de bacterias intracelulares y virus, especialmente en procesos relacionados con la evasión de la respuesta del sistema inmune.[5]
Historia
[editar]
La actina fue observada experimentalmente por primera vez en 1887 por W.D. Halliburton, quien extrajo una proteína muscular que coagulaba preparaciones de miosina, denominándolo «fermento de la miosina».[6] No obstante, Halliburton fue incapaz de efectuar la caracterización de sus observaciones, y por ello el descubrimiento se atribuye a Brúnó F. Straub, entonces un joven bioquímico que trabajaba en el laboratorio de Albert Szent-Györgyi en el Instituto de química médica de la Universidad de Szeged, en Hungría.

En 1942, Straub desarrolló una nueva técnica para la extracción de proteínas musculares que le permitía aislar cantidades sustanciales de actina relativamente pura. Este método es el mismo que esencialmente se utiliza en los laboratorios actualmente. Szent-Györgyi había descrito previamente una forma más viscosa de miosina, producida por extracciones lentas en músculo, como «miosina activada» y puesto que la proteína de Straub producía el efecto activador, la denominó actina. La viscosidad disminuía si se añadía ATP a la mezcla de ambas proteínas, conocida como actomiosina. El trabajo de ambos no pudo ser publicado en los países occidentales debido al ambiente bélico de la Segunda Guerra Mundial, saliendo a la luz en 1945 cuando fue publicado como suplemento de Acta Physiologica Scandinavica.[8] Straub continuó trabajando en la actina hasta 1950, publicando que podía unirse al ATP y que, durante la polimerización de la proteína para formar microfilamentos, se hidrolizaba a ADP + Pi, el cual permanecía unido al microfilamento. Straub sugirió que esta reacción desempeñaba un papel en la contracción muscular, pero esto solo es cierto en el caso del músculo liso y no fue verificado experimentalmente hasta 2001.[9][10]
La secuencia de aminoácidos fue completada por Elzinga y colaboradores en 1973,[11] y la estructura cristalográfica de la actina G fue determinada en 1990 por Kabsch y colaboradores, aunque se trataba de un cocristal en el que formaba un complejo con la desoxirribonucleasa I,[12] siendo propuesto un modelo el mismo año para la actina F que se extendían hasta 8,4 Å, por Holmes y sus colaboradores.[13] Este procedimiento de cocristalización con diferentes proteínas fue empleado repetidamente durante los siguientes años, hasta que en 2001 se logró cristalizar la proteína aislada junto con ADP. Fue posible gracias al empleo de un conjugado de rodamina que impedía la polimerización bloqueando el aminoácido cys-374.[14] [15]
Aunque en 2008 no existía un modelo de alta resolución de la forma filamentosa, el equipo de Sawaya realizó una aproximación más exacta basándose en múltiples cristales de dímeros de actina que contactan en diferentes lugares.[16] Ese modelo fue refinado por el propio autor y por Lorenz.
Otros enfoques, como el uso de criomicroscopía electrónica o radiación sincrotrón han permitido recientemente[¿cuándo?] aumentar el nivel de resolución y comprender con mayor profundidad la naturaleza de las interacciones y los cambios conformacionales[¿cuál?] implicados en la formación del filamento de actina.[17][18]
En 2011 se publicó una interesante revisión de las estructuras de la actina G y la actina F hasta ese año.[19]
En el año 2019 mediante crio-EM las reconstrucciones helicoidales de F-actina en diferentes estados de nucleótidos (ADP, ADP-Pi y análogos de ATP) proporcionaron información, con resolución de 3,6 ángstroms (Å), sobre la F-actina y los cambios de conformación que conducen a la hidrólisis de ATP tras la polimerización.[20]
En el 2023 se produjeron reconstrucciones tridimensionales, utilizando una tubería de selección de partículas basada en redes neuronales entrenadas a medida, del extremo puntiagudo libre con resolución de 2,84 Å, del extremo puntiagudo cubierto con Tmod a 3,26 Å y del extremo con púas cubierto con CapZ a 2,79 Å. Se determinó que las bases estructurales de los extremos son diferentes en su conformación: los puntiagudos están preparados para la adición de subunidades y los extremos con púas para la disociación de subunidades.[21]
Estructura
[editar]La actina es una de las proteínas más abundantes entre los eucariotas y se encuentra presente en todo el citoplasma.[4] De hecho, en las fibras musculares representa el 20 % en peso de proteína celular total y, en otras células animales, oscila entre el 1 y el 5 %. No obstante, no existe un único tipo de actina, sino que sus genes codificantes se encuentran definidos por una familia multigénica (familia que, en plantas, alberga más de 60 elementos, entre genes y pseudogenes y, en humanos, más de 30).[22] Esto significa que la información genética de cada individuo posee instrucciones para generar variantes de la actina (denominadas isoformas) que poseerán funciones ligeramente distintas. De este modo, los organismos eucariotas expresan distintos genes que dan lugar a: la actina α, que se encuentra en estructuras contráctiles; la actina β, en el borde en expansión de las células que emplean la proyección de estructuras celulares como método de movilidad; y la actina γ, en los filamentos de las fibras de estrés.[23] Además de las similitudes existentes entre las isoformas de un organismo, también existe una conservación evolutiva en cuanto a estructura y función entre organismos de incluso dominios distintos al eucariota: en bacterias se conoce el homólogo MreB, una proteína que es capaz de polimerizar en microfilamentos;[18] y en arqueas existe un representante (Ta0583) aún más similar a las actinas de eucariotas.[24]
La actina se presenta en la célula en dos formas: como monómeros globulares denominados actina G y como polímeros filamentosos denominados actina F (es decir, filamentos compuestos de multitud de monómeros de actina G). La actina F puede denominarse también microfilamento. A cada hebra de actina se une una molécula de adenosín trifosfato (ATP) o de adenosín difosfato (ADP) a su vez asociada a un catión Mg2+. De las distintas combinaciones posibles entre las formas de actina y el nucleótido trifosfato, en la célula predominan la actina G-ATP y la actina F-ADP.[25][26]
Actina G
[editar]En cuanto a su estructura molecular, la actina G posee una apariencia globular al microscopio electrónico de barrido; no obstante, mediante cristalografía de rayos X puede apreciarse que está compuesta de dos lóbulos separados por una hendidura; la estructura conforma el pliegue ATPasa, un centro de catálisis enzimática capaz de unir el ATP y Mg2+ e hidrolizar el primero a ADP más fosfato. Este pliegue es un motivo estructural conservado que también está presente en otras proteínas que interaccionan con nucleótidos trifosfato como la hexoquinasa (una enzima del metabolismo energético) o las proteínas Hsp70 (una familia de proteínas que contribuyen a que otras proteínas posean estructuras funcionales).[27] La actina G solo es funcional cuando posee o bien ADP o bien ATP en su hendidura; no obstante, en la célula predomina el estado unido a ATP cuando la actina se encuentra libre.[25]

La actina cristalizada por Kabsch, que es la más utilizada como modelo en estudios estructurales, puesto que fue la primera en ser purificada, procede del músculo esquelético de conejo. Tiene unas dimensiones aproximadas de 67 × 40 × 37 Å, una masa molecular de 41 785 Da y un punto isoeléctrico estimado en 4.8. Su carga neta a pH= 7 es de -7.[28][29]
- Estructura primaria
La secuencia de aminoácidos completa de este tipo de actina fue determinada por Elzinga y colaboradores en 1973, y afinada en trabajos posteriores por el mismo autor. Contiene 374 residuos de aminoácidos. Su extremo N-terminal es muy ácido. Comienza con un aspartato acetilado en su grupo amino, mientras que su C-terminal es básico, formado por una fenilalanina precedida por una cisteína de cierta importancia funcional. Ambos extremos se sitúan en una posición muy próxima dentro del subdominio I. En cuanto a aminoácidos anómalos, cabe destacar una Nτ-metilhistidina en posición 73.[28]
- Estructura terciaria-dominios
Está formada por dos dominios conocidos como grande y pequeño, separados por una hendidura en cuyo centro se sitúa el lugar de unión al ATP-ADP+Pi. Por debajo de este existe una escotadura de menor profundidad llamada «surco». Cuando se encuentran en forma nativa, a pesar de su nombre, ambos tienen un tamaño equiparable.[11]
En los estudios topológicos, por convención, la proteína se orienta de manera que el dominio mayor queda a la izquierda, mientras que el menor se sitúa a la derecha. En esta posición, el dominio pequeño se divide a su vez en el subdominio I (posición inferior, residuos 1-32, 70-144 y 338-374) y subdominio II (posición superior, residuos 33-69). El dominio mayor también se divide en otros dos, el subdominio III (inferior, residuos 145-180 y 270-337) y el subdominio IV (superior, residuos 181-269). La zona expuesta de los subdominios I y III se denomina extremo «barbado», mientras que a la de los subdominios II y IV se le llama extremo «en punta de flecha». Esta denominación hace referencia al hecho de que, debido a la pequeña masa del subdominio 2, la actina adquiere polaridad, que se discutirá posteriormente al hablar de la dinámica de ensamblaje. Algunos autores nombran los subdominios como Ia, Ib, IIa y IIb, respectivamente.[30]
- Otras estructuras destacadas
- La estructura supersecundaria más destacada es una β-lámina de cinco cadenas que se componen de un β-meandro y una unidad β-α β dextrógira. Está presente en ambos dominios. Esto sugiere que la proteína surgió por duplicación génica.[12]
- El lugar de unión al adenosín nucleótido se encuentra entre dos estructuras en forma de horquilla β pertenecientes a los dominios 1 y 3. Los residuos implicados son Asp11-Lys18 y Asp154-His161 respectivamente.
- Justo debajo del nucleótido se encuentra el lugar de unión al catión divalente, que in vivo es con mayor probabilidad el Mg2+ o el Ca2+ mientras que in vitro es el formado por una estructura quelante en la que contribuyen la Lys18 y dos oxígenos de los fosfatos α y β del nucleótido. Este calcio está coordinado con seis moléculas de agua que se encuentran retenidas por los aminoácidos Asp11, Asp154, y Gln137. Junto con el nucleótido forma un complejo que restringe los movimientos de una región llamada bisagra o hinge, situada entre los residuos 137 y 144, manteniendo de esta manera la forma nativa de la proteína, hasta el punto de que su retirada desnaturaliza el monómero de actina. Esta región también es importante, porque determina las conformaciones «abierta» o «cerrada» de la hendidura de la proteína.[30][14]
- Con casi toda probabilidad existen al menos otros tres centros con menor afinidad (intermedia) y otros de baja afinidad para cationes divalentes. Se ha especulado sobre el papel de estos centros en la polimerización de la actina actuando en la etapa de activación.[30]
- En el subdominio 2 existe una estructura, llamada bucle-D o D-loop debido a que se une a la ADNasa I, situada entre los residuos His40 y Gly48 que aparece como un elemento desordenado en la mayoría de los cristales y como una lámina β cuando está formando complejo con la ADNasa I. Según Domínguez et al., el evento clave de la polimerización sería la propagación de un cambio conformacional desde el centro de unión al nucleótido hasta este dominio, que pasaría de ser un bucle a una hélice. Esta teoría parece ser refutada por otros trabajos.[14][31]
Actina F
[editar]Una descripción clásica afirma que la actina F tiene una estructura filamentosa interpretable como una hélice levógira monocatenaria con giro de 166° e incremento de 27.5 ángtroms (Å) o bien como una hélice dextrógira bicatenaria con medio paso de rosca de 350-380 Å, estando cada actina rodeada de otras cuatro.[32] La simetría del polímero de actina, que es de unas 2.17 subunidades por vuelta de hélice es incompatible con la formación de cristales, que solo es posible cuando estas son exactamente 2, 3, 4 o 6 subunidades por vuelta. Por tanto, se deben efectuar modelos interpretando datos procedentes de técnicas que salvan estos inconvenientes, como la microscopía electrónica, la criomicroscopía electrónica, cristales de dímeros en distintas posiciones o difracción de rayos X.[18] Es necesario precisar que hablar de una «estructura» no es correcto para algo tan dinámico como un filamento de actina. En realidad se debería hablar de distintos estados estructurales, entre los cuales el dato más constante es el incremento de 27.5 Å, mientras que la rotación de las subunidades muestra una considerable variabilidad, siendo normal observar desplazamientos de hasta el 10 % de su posición ideal. Algunas proteínas, como la cofilina, parecen incrementar el ángulo de giro, pero nuevamente se puede interpretar que, en lugar de ello, estabilizan algunos «estados estructurales» normales. Estos podrían ser importantes en el proceso de polimerización.[33]
En cuanto al radio de giro o grosor del filamento, las medidas son más controvertidas: mientras los primeros modelos le asignaban una longitud de 25 Å, datos actuales de difracción de rayos X respaldados por criomicroscopía electrónica coinciden en unos 23.7 Å. Estos mismos estudios han determinado con bastante precisión los puntos de contacto entre monómeros. Unos se establecen con unidades de la misma cadena, entre el extremo «barbado» de un monómero y el extremo «en punta de flecha» del siguiente, mientras que los monómeros de cadenas adyacentes hacen contacto lateralmente mediante proyecciones del subdominio 4, siendo las más importantes la formada por el C-terminal y un enlace hidrofóbico formado por tres cuerpos en los que intervienen los residuos 39‑42, 201‑203 y 286. Para formar parte de un filamento, según este modelo, los monómeros estarían en una configuración llamada «plana», en la que los subdominios giran entre sí, y que también parece encontrarse en el homólogo bacteriano de la actina MreB.[18]
Puesto que todas las subunidades de un microfilamento apuntan hacia el mismo extremo, se dice que el polímero presenta polaridad en su estructura. Este hecho da lugar a una convención: se nombra al extremo que posee una subunidad de actina exponiendo el lugar por el que une ATP al medio como «extremo (−)» mientras que en el opuesto, en el cual la hendidura está dirigida a otro monómero adyacente, es el «extremo (+)».[23] La denominación «en punta de flecha» y «barbado» de los extremos de los microfilamentos se debe a su aspecto al microscopio electrónico de transmisión cuando se procesan mediante una técnica denominada «decoración». Este método consiste en la adición de elementos S1 de la miosina en tejidos fijados con ácido tánico; esta miosina une de forma polar a los monómeros de actina, lo que da lugar a una configuración semejante a flechas con plumas a lo largo de todo su fuste, donde el fuste correspondería a la actina y las plumas a la miosina. De este modo, el extremo del microfilamento que queda sin miosina sobresaliendo se interpreta como la punta de la flecha, mientras el opuesto se denomina barbado.[34]
En el músculo, el filamento helicoidal de la actina F contiene también una molécula de tropomiosina, una proteína de una longitud de 40 nanómetros que se enrolla alrededor de la hélice de actina F. Durante el estado de reposo celular, la tropomiosina recubre los sitios activos de la actina de modo que no se logra la interacción actina-miosina que produce la contracción muscular. Unidas a lo largo de la hebra de tropomiosina hay otras moléculas proteicas, las troponinas, complejos de tres polímeros: troponina I, troponina T y troponina C.[35]
Plegamiento
[editar]
La actina puede adquirir espontáneamente una gran parte de su estructura terciaria.[37] Sin embargo, muestra un comportamiento muy especial y casi único en la forma en que adquiere su forma plenamente funcional a partir de su forma nativa recién sintetizada. La razón de una ruta tan especial podría ser la necesidad de evitar la presencia de monómeros de actina mal plegados, que serían tóxicos, puesto que podrían actuar de terminadores inadecuados de la polimerización. En cualquier caso, es clave para la estabilidad del citoesqueleto, y no solo esto, sino que podría ser un proceso esencial para la coordinación del ciclo celular.[38][39]
Para ello emplea obligadamente un tipo de chaperonina (proteína que ayuda a otras a plegarse) citosólica del grupo II, la CCT, formada por un doble anillo de ocho subunidades diferentes (heteroctamérico) que se distingue de las demás chaperonas moleculares, y en especial de su homóloga en arqueas GroEL en que no precisa de una co-chaperona que actúe de tapadera sobre la cavidad central catalítica. Acepta sustratos uniéndose a ellos mediante dominios específicos, por lo que en principio se pensó que era exclusiva de actina y tubulina, aunque actualmente se ha visto por inmunoprecipitación que al menos interactúa con un gran número de polipéptidos, posiblemente como sustratos. Actúa mediante cambios conformacionales dependientes de ATP, necesitando en ocasiones de varias rondas de liberación y catálisis para completar su trabajo.[40]
Para su correcto plegamiento, la actina y la tubulina también necesitan específicamente del concurso de otra proteína, la prefoldina, un complejo heterohexamérico (formado por seis subunidades distintas), y tan específicamente que incluso han coevolucionado. En el caso de la actina, se une inmediatamente a ella mientras aún se está traduciendo, aproximadamente cuando tiene una longitud de 145 aminoácidos, que son los correspondientes al dominio N-terminal.[41]
Se emplean subunidades de reconocimiento diferentes para la actina y la tubulina, aunque solapadas. Probablemente en el caso de la actina se trata de las subunidades PFD3 y PFD4 que se unen a la actina en dos lugares, el I, entre los residuos 60-79 y el II, entre los residuos 170-198. La actina se reconoce, carga y entrega a la CCT en conformación abierta por la parte interna del extremo de los «tentáculos» de la prefoldina (ver imagen y nota al pie).[n. 1] El contacto en el momento de la entrega es tan breve que no se llega a formar un complejo ternario, liberándose la prefoldina de inmediato.[36]

Posteriormente, la chaperonina citosólica (CCT) efectúa el plegamiento de la actina de forma secuencial, y formando uniones con las subunidades, en lugar de simplemente encerrarla en su cavidad.[n. 2] Para ello posee zonas específicas de reconocimiento en su dominio β apical. La primera etapa del plegamiento consistiría en el reconocimiento de los residuos 245-249. Posteriormente, otros determinantes establecerían contacto.[42] Tanto la actina como la tubulina se unen a la CCT en conformaciones abiertas en ausencia de ATP. En el caso de la actina, en cada cambio conformacional se une a dos subunidades, a diferencia de la tubulina, que lo hace a cuatro. La actina tiene secuencias de unión específicas, interactuando con las subunidades CCTδ y β o bien con CCTδ y CCTε. Tras la unión de AMP-PNP a la CCT, los substratos van moviéndose por la cavidad de la chaperonina. Parece ser también que en el caso de la actina se precisa la proteína CAP como un posible cofactor en los estadios finales del plegamiento de la actina.[39]
Aún no se conoce con exactitud la regulación de este proceso, pero se sabe que la proteína PhLP3 (proteína semejante a la fosducina) regula su actividad inhibiéndola, mediante la formación de un complejo ternario.[40]
Mecanismo catalítico de la ATPasa
[editar]La actina es una ATPasa, es decir, una enzima que hidroliza ATP. Este conjunto de enzimas se caracteriza por actuar con extrema lentitud. Se sabe que esta ATPasa se «activa», o lo que es lo mismo, su velocidad aumenta unas 40 000 veces cuando la actina forma parte de un filamento.[33] Un valor de referencia para esta tasa de hidrólisis bajo ciertas condiciones ideales sería de 0.3 s-1. Posteriormente, el Pi permanecería largo tiempo unido a la actina junto al ADP, liberándose cerca del extremo del filamento.[43]
Actualmente no se conocen los detalles moleculares concretos del mecanismo catalítico. Aunque existe mucha polémica al respecto, parece claro que para la hidrólisis de ATP se precisa una conformación «cerrada», y se cree que acerca los residuos implicados a la distancia adecuada.[33] Uno de los residuos clave sería Glu137, situado en el subdominio 1. Su función sería anclar la molécula de agua que produce un ataque nucleofílico al enlace del fosfato γ del ATP, mientras el nucleótido se une fuertemente a los subdominios 3 y 4. La lentitud del proceso catalítico se debería a la gran distancia y posición sesgada de esta molécula de agua con respecto a su reactante. Con mucha probabilidad, el cambio conformacional que se produce por rotación de dominios entre las formas G y F de la actina acerca la Glu137, permitiendo su hidrólisis. Según este modelo, la polimerización y la función ATPasa estarían desacopladas en un primer momento.[18]
Dinámica de ensamblaje
[editar]
La actina F combina las cualidades de ser resistente y dinámica. A diferencia de otros polímeros, como el ADN, que mantienen unidos sus elementos constitutivos mediante enlaces covalentes, en los filamentos de actina los monómeros se ensamblan por enlaces más débiles de tipo no covalente. Esto, que en principio debilita la estructura, puesto que se podría romper por agitación térmica, se soluciona mediante los enlaces laterales con los monómeros vecinos. Al mismo tiempo, los enlaces débiles mantienen la ventaja de que los extremos del filamento pueden liberar o incorporar fácilmente monómeros, de manera que se pueden remodelar rápidamente y cambiar la estructura celular de la que son responsables en respuesta a estímulos ambientales. Esto último y el mecanismo bioquímico por el que se efectúa es lo que se conoce como «dinámica de ensamblaje».[5]
- Estudios in vitro
Los estudios de la dinámica de adición y pérdida de subunidades de los microfilamentos se han realizado in vitro (es decir, en el laboratorio, fuera de sistemas celulares) debido a que el polímero de actina resultante da lugar a la misma actina F producida in vivo, donde este proceso está controlado por multitud de proteínas para responder a las necesidades celulares, de modo que sería muy difícil observar sus condiciones básicas.[44] In vitro, este hecho se produce de forma secuencial: primero, se da una «fase de activación», en la que la unión e intercambio de cationes divalentes en lugares específicos de la actina G, unido a ATP, producen un cambio conformacional, conocido a veces como Actina G* o monómero de actina F, puesto que es más parecida a las unidades que se sitúan en el filamento.[30] Esto la prepara para la siguiente «fase de nucleación», en la cual la actina G da lugar a pequeños fragmentos inestables de actina F capaz de polimerizar. Inicialmente se forman dímeros y trímeros de manera inestable. Cuando el número de estos es lo suficientemente grande, tiene lugar la «fase de elongación», en la que el filamento se forma y crece rápidamente mediante la adición reversible de nuevos monómeros a ambos extremos.[45] Finalmente, en el «equilibrio estacionario», los monómeros de actina G se intercambian en los extremos del microfilamento sin que varíe la longitud total del polímero.[4] En esta última fase se define la «concentración crítica Cc» como la relación entre las constantes de ensamblaje y desensamblaje (se trata, pues, de una constante de disociación), y representa la concentración de actina G en la cual la dinámica de adición y eliminación de monómeros no produce una modificación en la longitud del microfilamento. En las condiciones usuales in vitro, Cc es de 0.1 μM,[46] lo que significa que a valores mayores se da una polimerización y a valores menores, una despolimerización.[47]
- Papel de la hidrólisis de ATP
Un asunto importante que se introdujo en el apartado anterior es el hecho de que, aunque la actina hidroliza ATP, todo parece indicar que esto no interviene en el ensamblaje, puesto que, por una parte, la hidrólisis se produce en gran medida en el interior del filamento, y por otra, el ADP también puede polimerizar. Esto plantea la cuestión de comprender cuál es el proceso termodinámicamente desfavorable que requiere un gasto de energía tan ingente. El llamado «ciclo de la actina», que liga la hidrólisis a la polimerización, consiste en la adición de monómeros de Actina G-ATP preferentemente en el extremo barbado, creando un flujo de monómeros hacia el extremo en punta de flecha en lo que se conoce como «trenzamiento» (threadmilling, en inglés), donde los monómeros estarían en forma de Actina F-ADP y serían liberados, intercambiando posteriormente este ADP por ATP y cerrando de ese modo el ciclo.
Poco después de la adición, se produce la hidrólisis del ATP de forma relativamente rápida. Existen dos hipótesis sobre cómo se produce, la estocástica, en la que la hidrólisis se produciría al azar influida en cierto modo por las moléculas vecinas, y la vectorial, en la que solo se produciría en el límite con otras moléculas que ya han hidrolizado su ATP. En cualquier caso, no se libera el Pi resultante, sino que permanece un tiempo unido no covalentemente a la actina ADP, con lo cual existirían tres especies de actina en un filamento: ATP-Actina, ADP+Pi-Actina y ADP-Actina.[43] El contenido de un filamento en cada una de estas especies depende de su longitud y estado: al comienzo de la elongación, el filamento tiene una composición aproximadamente equivalente de monómeros con ATP y ADP+Pi y una pequeña cantidad junto al extremo (−) de Actina ADP. A medida que se alcanza el estado estacionario, la situación se invierte, estando la mayor parte del filamento con ADP y el extremo (+) prácticamente solo con ADP+Pi, con el ATP reducido al extremo.[48]
Si comparamos los filamentos de actina-ADP puros con aquellos que incorporan ATP, en los primeros las constantes críticas son similares en ambos extremos, mientras que en los otros dos nucleótidos la Cc es diferente: En el extremo (+) es Cc+=0.1 μM, mientras que en el extremo (−) es Cc−=0.8 μM, con lo cual se dan las siguientes situaciones:[23]
- Para concentraciones de actina G-ATP menores a Cc+ no se produce la elongación del filamento.
- Para concentraciones de actina G-ATP menores que Cc−, pero mayores que Cc+ la elongación se da en el extremo (+).
- Para concentraciones de actina G-ATP mayores que Cc− el microfilamento crece en ambos extremos.
Por tanto, se puede deducir que la energía de la hidrólisis se utiliza para crear un verdadero «estado estacionario», es decir, de un flujo en lugar de un simple equilibrio, lo cual dota de dinamismo, polaridad y fuerza de tracción al filamento, lo que justifica el gasto por la ganancia de funciones biológicas esenciales.[43] Además, la configuración de los distintos tipos de monómeros es detectada por las proteínas de unión a la actina que controlan este dinamismo, como se verá en la próxima sección.
Parece existir una excepción en la forma de acoplamiento típica de los microfilamentos mediante trenzado o threadmilling en los esterocilios. En este caso, el control del tamaño de la estructura sería totalmente apical y de alguna manera controlada por la expresión génica, es decir, por la cantidad total de monómero de proteína sintetizada en un momento dado.[49]
Proteínas asociadas
[editar]
In vivo, el citoesqueleto de actina no está compuesto exclusivamente de actina, sino que para su generación, permanencia y función requiere de otras proteínas; estas se denominan proteínas de unión a la actina (ABP, actin binding proteins) e intervienen en su polimerización y despolimerización, estabilidad, su organización en haces o redes, su fragmentación y destrucción.[4] La diversidad de estas proteínas es tal, que se considera que la actina es la proteína que participa en el mayor número de interacciones proteína-proteína de cuantas se conocen.[51] Por ejemplo, existen elementos que secuestran la actina G, impidiendo su incorporación a los microfilamentos. De igual manera, existen proteínas que estimulan su polimerización o que dotan de complejidad a las redes en síntesis.[23]
- La timosina β4 es una proteína de 5 kDa capaz de unirse a la actina G-ATP en una estequiometría 1:1; esto quiere decir que una unidad de timosina β4 se une a otra de actina G, en esta proporción. Su papel es impedir la incorporación de los monómeros al polímero en crecimiento.[52]
- La profilina, una proteína citosólica de 15 kDa que también se une en estequiometría 1:1 a los monómeros de actina G-ATP, pero su función es distinta: facilita el intercambio de nucleótidos ATP por ADP. Además, está implicada en otras funciones celulares, como la unión de repeticiones de Pro en otras proteínas o de lípidos que actúan como segundos mensajeros.[53][54]

Otras proteínas de unión a actina regulan la longitud de los microfilamentos realizando cortes en ellos, lo que da lugar a nuevos extremos activos para la polimerización. Es decir, si un microfilamento, que posee dos extremos a los que pueden unirse o disociarse monómeros, es cortado dos veces, resultan tres nuevos microfilamentos con seis extremos; la nueva situación favorece la dinámica de ensamblaje y desensamblaje. Entre estas proteínas destacan la gelsolina y la cofilina. Cabe resaltar que primero realizan el corte mediante cambios en la conformación del monómero de actina al que se unen en el polímero, quedando después recubriendo el nuevo extremo (+) generado, lo que impide el agregado o el intercambio de nuevas subunidades de actina G y, puesto que los extremos (-) quedan sin recubrir, favorecen la despolimerización de los filamentos.[56]
Otro tipo de proteínas de unión a actina recubren los extremos de la actina F a fin de estabilizarlos, sin capacidad de romperlos. Ejemplos de estas proteínas son CapZ (que une los extremos (+) según los niveles de Ca2+/calmodulina de la célula, niveles que dependen de señales externas e internas de la célula y que intervienen en la regulación de sus funciones biológicas)[57] o la tropomodulina (que une los extremos (-)). La tropomodulina es esencial como estabilizador de la actina F presente en las miofibrillas de los sarcómeros del músculo, estructuras caracterizadas por su gran estabilidad.[58]

El complejo Arp2/3 se encuentra ampliamente difundido en todos los organismos eucariotas.[60] Está compuesto por siete subunidades, algunas de las cuales poseen una topología claramente relacionada con su función biológica: dos de sus subunidades, denominadas «ARP2» y «ARP3», poseen una estructura muy semejante a los propios monómeros de actina. Dicha homología permite a ambas unidades comportarse como agentes nucleantes de la polimerización de los monómeros de actina G a actina F. Además, este complejo es necesario para establecer estructuras dendríticas y en anastomosis (esto es, bifurcadas o en red), por tanto, más complejas, de actina F.[61]
Inhibidores químicos
[editar]
Existen varias toxinas que interfieren con la dinámica de las actinas, tanto despolimerizándolas (latrunculina y citocalasina D) como estabilizándolas (faloidina):
- La latrunculina, una toxina producida por poríferos, se une a la actina G impidiendo su unión a los microfilamentos.[62]
- La citocalasina D, un alcaloide producido por hongos, se une al extremo (+) de la actina F impidiendo la adición de nuevos monómeros.[63] Se han descrito efectos de la citocalasina D, mediados por la disrupción de la dinámica de actinas, en la actividad de p53 (en animales)[64] o en respuestas gravitrópicas (en plantas).[65]
- La faloidina, una toxina aislada del hongo Amanita phalloides, se une a la interfaz existente entre los monómeros de actina adyacentes del polímero de actina F, lo que evita la despolimerización de aquel.[63]
Funciones y localización
[editar]La actina como proteína se encuentra tanto en el citoplasma como en el núcleo celular.[66] Dicha localización está regulada por las vías de transducción de señales que integran los estímulos que la célula recibe y que permite la reestructuración de las redes de actina en respuesta a aquellos. En Dictyostelium, se ha referido la intervención de la ruta de fosfoinosítidos mediada por la fosfolipasa D.[67] Los filamentos de actina son especialmente abundantes y estables en las fibras musculares. Dentro del sarcómero (la unidad morfológica y fisiológica de las fibras musculares) la actina se dispone en las bandas I y A; en esta última, se presenta conjuntamente con la miosina.[68]
Citoesqueleto
[editar]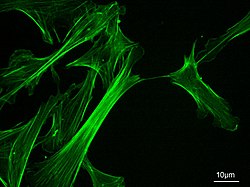
Los microfilamentos intervienen en el movimiento de todas las células móviles, incluso las no musculares, pues se ha descrito que los fármacos que desorganizan la actina F (como las citocalasinas) afectan a la actividad de dichas células. Como proteína, la actina supone el 2 % del total de proteínas en hepatocitos, el 10 % en fibroblastos, el 15 % en amebas y hasta el 50-80 % en plaquetas activadas.[69] Existen distintos grupos de actina, con estructura y función ligeramente distintas. De este modo, la actina α es exclusiva de fibras musculares, y la presente en otras células suele ser del tipo β y γ. Además, la actina de tipos distintos a la α suele poseer una alta tasa de recambio que provoca que la mayor parte de ella no forme parte de estructuras permanentes. Así, los microfilamentos en las células no musculares aparecen de dos formas:[70]
- Redes de microfilamentos. Bajo la membrana plasmática es común en células animales la aparición de una corteza celular poblada por multitud de microfilamentos que excluye la presencia de orgánulos. Esta red está en relación con abundantes receptores celulares que transducen señales del exterior de la célula.
- Haces de microfilamentos. Estos microfilamentos, dispuestos en redes, son de mayor longitud y, en asociación con proteínas contráctiles como la miosina no muscular, intervienen en el desplazamiento de sustancias a nivel intracelular.
Levaduras
[editar]En levaduras, el citoesqueleto de actina es clave durante los procesos de endocitosis, citocinesis, determinación de la polaridad celular y durante la morfogénesis. Estos hechos, además de depender de la actina, implican a 20 o 30 proteínas asociadas, altamente conservadas evolutivamente, así como multitud de moléculas de señalización; estos elementos permiten, en combinación, un ensamblaje espacial y temporalmente modulado que define la biología celular en respuesta a estímulos internos y externos.[71]
Las levaduras poseen tres grandes tipos de elementos producto de la asociación de la actina: parches, cables y anillos que, pese a detectarse durante largos periodos de tiempo, se ven sometidos a un equilibrio dinámico debido a la continua polimerización y despolimerización. Como proteínas accesorias, poseen una cofilina/ADF de 16 kDa (codificada por un único gen, denominado COF1); Aip1, un cofactor de la cofilina que favorece el desensamblado de los microfilamentos; Srv2/CAP, un regulador de la dinámica relacionado con proteínas adenilil ciclasas; una profilina de aproximadamente 14 kDa que se asocia a los monómeros de actina; y twinfilina, una proteína de 40 kDa implicada en la organización de las estructuras tipo parche.[71]
Plantas
[editar]Los estudios de genómica de plantas han revelado la existencia de isovariantes proteicas dentro de la familia de genes de la actina; dentro de Arabidopsis thaliana, una dicotiledónea empleada como organismo modelo, existen al menos diez tipos de actinas, nueve de α tubulinas, seis de β tubulinas, seis de profilinas y docenas de miosinas. Tal diversidad se explica de acuerdo con la necesidad evolutiva de poseer variantes ligeramente diferentes en su pauta de expresión temporal y espacial; no obstante, la mayoría de ellas se expresan conjuntamente en los tejidos analizados. El entramado de redes de actina se distribuye por todo el citoplasma de las células cultivadas in vitro, con un refuerzo en torno al núcleo que se conecta, mediante radios, a la corteza celular; dicho entramado es altamente dinámico, con un polimerizado y despolimerizado continuo.[72]

Si bien las células vegetales poseen generalmente una pared que define su morfología e impide su movimiento, sus microfilamentos generan las fuerzas necesarias para varias actividades celulares, por ejemplo, las corrientes citoplasmáticas generadas por los microfilamentos y las miosinas. Además, la actina interviene en el movimiento de orgánulos y morfogénesis celular, procesos que incluyen la división celular, la elongación y la diferenciación.[74]
En cuanto a las proteínas asociadas al citoesqueleto de actina presentes en plantas cabe mencionar:[74] la villina, una proteína perteneciente a la familia de la gelsolina/severina, capaz de cortar microfilamentos y unir monómeros de actina en presencia del catión calcio; la fimbrina, un elemento capaz de reconocer y unir monómeros de actina y que interviene en la formación de entramados (mediante una regulación diferente a la propia de células animales y levaduras);[75] las forminas, proteínas capaces de actuar como agente nucleante de la polimerización a actina F; la miosina, típico motor molecular propio de eucariotas que, en Arabidopsis thaliana, está codificado por 17 genes clasificados en dos clases distintas; CHUP1, capaz de unir actina e implicado en la distribución espacial de los cloroplastos en la célula; KAM1/MUR3, una proteína que define la morfología del complejo de Golgi así como la composición en xiloglucanos de la pared celular; NtWLIM1, proteína que faculta la aparición de estructuras aovilladas de actina; y ERD10, que participa en la asociación entre orgánulos delimitados por membranas y los microfilamentos y que parece desempeñar un papel especialmente relevante en presencia de estrés.
Contracción muscular
[editar]
En el músculo, el filamento helicoidal de la actina F contiene también una molécula de tropomiosina, una proteína de una longitud de 40 nanómetros que se enrolla alrededor de la hélice de actina F. Durante el estado de reposo celular, la tropomiosina recubre los sitios activos de la actina de modo que no se logra la interacción actina-miosina (esta interacción da lugar a un deslizamiento entre ambos que, por coordinación de muchos copias de estos elementos dispuestos en los músculos, produce su contracción). Unidas a lo largo de la hebra de tropomiosina hay otras moléculas proteicas, las troponinas, complejos de tres polímeros: troponina I, troponina T y troponina C.[35] La función moduladora de la tropomiosina depende de la interacción con la troponina en presencia de iones de Ca2+.[76]
La actina, junto con la miosina, interviene en la contracción y relajación de los músculos, constituyendo las dos alrededor del 90 % de las proteínas musculares.[77] El proceso global se dispara mediante una señal externa, típicamente mediante un potencial de acción excitador del músculo que alberga las células especializadas ricas en filamentos de actina y miosina en su interior. El ciclo de contracción-relajación responde a los siguientes pasos:[78]
- Despolarización del sarcolema y transmisión del potencial de acción a través de los túbulos T.
- Apertura de canales de Ca2+ del retículo sarcoplásmico.
- Aumento de la concentración citosólica de Ca2+ e interacción de estos cationes con la troponina causando una modificación en su conformación, lo que altera a su vez la estructura de la tropomiosina, que recubre el sitio activo de la actina, permitiendo el establecimiento de los enlaces cruzados miosina-actina (esta última presente como filamentos delgados).[35]
- Movimiento de las cabezas de miosina sobre los filamentos delgados, tanto de forma independiente como dependiente de ATP. Este último mecanismo, mediado por la actividad ATPasa de las cabezas de miosina, provoca el movimiento de los filamentos de actina hacia el disco Z.
- Captura del Ca2+ por parte del retículo sarcoplásmico, que provoca un nuevo cambio conformacional en la tropomiosina que inhibe la interacción actina-miosina.[77]
Otros procesos biológicos
[editar]El estudio clásico de la función de la actina la circunscribe al mantenimiento del citoesqueleto y, por ello, a la organización y movimiento de los orgánulos y determinación de la forma celular.[70] No obstante, el papel de la actina es bastante más amplio en la fisiología celular eucariota; más aún, existen elementos semejantes en procariotas.
- Citocinesis. En las células animales y de levaduras, la división celular suele conllevar la separación de la célula madre en dos células hijas mediante la constricción de su zona ecuatorial. En este proceso interviene un anillo contráctil de actina, miosina y α actinina.[79] En la levadura de fisión Schizosaccharomyces pombe, la actina se ensambla activamente en el anillo contráctil con la participación de Arp3, la formina Cdc12, profilina y WASp, si bien intervienen también microfilamentos preformados. Una vez constituido el anillo, la estructura se mantiene en un continuo ensamblado/desensamblado que, con la ayuda del complejo Arp2/3 y de las forminas, deviene en un proceso central de la citocinesis.[80] El conjunto de anillo contráctil, microtúbulos del huso acromático y el material denso periférico se denomina «cuerpo de Fleming» o «cuerpo intermedio».[70]
- Apoptosis. Durante la muerte celular programada, la familia de proteasas denominadas ICE/ced-3 (de la familia de las proteasas conversoras de interleuquina-1β) degradan in vivo la actina en dos fragmentos de 15 kDa y 31 kDa, lo que supone uno de los mecanismos de destrucción de la viabilidad celular en que se basa la apoptosis.[81] También se ha citado esta destrucción mediante la proteasa calpaína;[82] tanto es así, que el empleo de inhibidores de la calpaína disminuye la proteólisis de la actina e, incluso, la degradación del ADN (otro de los elementos característicos de la apoptosis).[83] Por otro lado, la inducción del proceso de apoptosis mediante un estrés pasa por la reorganización del citoesqueleto de actina (lo que implica también su polimerización), dando lugar a las estructuras denominadas fibras de estrés; este hecho está señalizado mediante la vía de las MAP kinasas.[84]
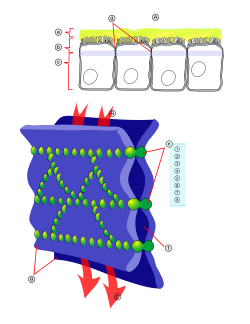
- Adhesión celular y desarrollo. La adhesión entre células es un carácter de los organismos pluricelulares que sustenta la capacidad de especialización tisular y, por ello, el aumento de la complejidad de aquellos. Las uniones celulares de los epitelios emplean el citoesqueleto de actina, dentro de cada célula, y las cadherinas, como elementos extracelulares, con una conexión entre ambas mediada por cateninas.[85] La interrupción de la dinámica de actinas repercute en el desarrollo de los organismos; de hecho, la actina es un elemento tan crucial que, generalmente, se dispone de sistemas de genes redundantes. Por ejemplo, los ejemplares de Dictyostelium a los que se les había privado del gen de la α actinina o del factor gelificante no mostraban un fenotipo anómalo posiblemente debido a que una de las proteínas podía realizar la función de la otra; en cambio, en los dobles mutantes, carentes de ambas, el desarrollo se vio alterado.[86]
- Modulación de la expresión génica. El estado de polimerización de actina influye en la pauta de expresión génica. En el año 1997, en trabajos empleando células de Schwann se detectó que la despolimerización mediada por citocalasina D provocaba una pauta de expresión peculiar de los genes implicados en la mielinización de este tipo de célula nerviosa.[87] En cuanto a los organismos unicelulares, en alguna de sus fases vitales se ha demostrado que la actina F también modifica el transcriptoma en el hongo Candida albicans.[88] Además, proteínas semejantes a la actina desempeñan un papel regulador durante la espermatogénesis en el ratón[89] y, en levaduras, se ha propuesto un papel de proteínas semejantes a actina en la modulación epigenética.[90] De hecho, la actina es capaz, junto con un tipo de miosina nuclear de interactuar con ARN polimerasas y otras enzimas de la maquinaria transcripcional, de actuar como iniciador de la transcripción.[66]
- Dinámica de estereocilios. Algunos tipos de células desarrollan en su superficie unas finas evaginaciones filiformes con función mecanosensorial denominadas estereocilios. Por ejemplo, estos orgánulos son los implicados en el sentido del oído en el órgano de Corti. Como característica principal, estas estructuras poseen una longitud que puede modificarse.[91] En cuanto a su arquitectura molecular, los estereocilios poseen un núcleo paracristalino de actina en equilibrio dinámico con los monómeros presentes en el citosol adyacente. A lo largo de este núcleo se disponen miosinas de los tipos VI y VIIa, mientras que la miosina XVa lo está en sus extremos y en cantidades proporcionales a la longitud del estereocilio.[92]
Patología molecular
[editar]En la mayoría de los mamíferos existen seis genes diferentes de actina. Dos de ellos están relacionados con el citoesqueleto (ACTB y ACTG1) mientras que las cuatro restantes lo están con el músculo esquelético (ACTA1), músculo liso (ACTA2), músculo liso entérico (ACTG2) y con el músculo cardíaco (ACTC1). Las mutaciones que afectan a estos genes eran desconocidas hasta 1998, y se ha visto que producen miopatías, variaciones en el tamaño y la función cardíaca y sordera. Así mismo, la actina del citoesqueleto está implicada en el mecanismo de patogenicidad de múltiples agentes infecciosos, incluyendo el VIH. La inmensa mayoría de las mutaciones que afectan a la actina son de tipo puntual y tienen un efecto dominante, salvo al menos seis mutaciones de miopatía nemalínica. Ello se debe a que en muchos casos la variedad mutante del monómero de actina actúa haciendo de «capping», es decir, como terminador de la elongación de la actina F.[30]
Relacionada con ACTA1
[editar]ACTA1 es el gen que codifica la isoforma α de la actina humana presente principalmente en el músculo esquelético, aunque también se expresa en el músculo cardíaco y en la glándula tiroides.[93] Su secuencia consta de siete exones, que producen cinco transcritos conocidos.[94] A fecha de 2006, el ENMC (European Neuromuscular Centre) había publicado 116 mutaciones relacionadas con patologías, conocidas como actinopatías. La mayor parte de ellas consisten en sustituciones puntuales de aminoácidos, que en muchos casos pueden ser asociadas con el fenotipo que determina la severidad y el curso de la afección.[30][94]

Se manifiestan alterando la estructura y la función del músculo esquelético produciendo tres formas de miopatía: miopatía nemalínica tipo 3, miopatía congénita con exceso de microfilamentos (CM) y miopatía congénita con desproporción de tipos de fibra (CFTDM). También se ha detectado mutaciones que producen miopatía con cores (zonas desprovistas de actividad oxidativa).[96] Aunque sus fenotipos son similares, además de la miopatía nemalínica típica y la de bastones intranucleares, algunos especialistas distinguen un tipo de miopatía, llamada actínica de la miopatía nemalínica. En la primera se acumulan agregados de actina en lugar de los típicos bastones. Es importante señalar que un paciente puede mostrar más de uno de estos fenotipos en la biopsia.[97] Los síntomas más habituales consisten en una morfología facial típica (facies miopática), debilidad muscular y retraso en el desarrollo motor y dificultades respiratorias. El curso, la gravedad y la edad de aparición son muy variables, y se encuentran formas de miopatía solapadas. En la miopatía nemalínica aparecen unas estructuras no patognomónicas en diversas localizaciones de las fibras musculares tipo 1 conocidas como «bastones nemalínicos», con una composición similar a los discos z del sarcómero.[98]
La patogénesis es muy variada. Muchas mutaciones se dan en la zona de hendidura de la actina, próximas al lugar de unión para nucleótidos, mientras que otras se dan en dominio 2, o bien en las zonas de interacción con las proteínas asociadas, lo que explica la gran variedad de agregados que se forman en estos casos, como cuerpos nemalínicos, intranucleares o cuerpos zebra.[30] En la miopatía nemalínica se producen cambios en el plegamiento y en las propiedades de agregación de la actina, y también en la expresión de otras proteínas asociadas. En algunas variantes en las que se encuentran cuerpos intranucleares, el cambio en el plegamiento oculta la señal de exportación nuclear, de modo que la agregación de la forma mutante de actina se produce en el núcleo celular.[99] En cambio, parece que en las mutaciones de ACTA1 que dan lugar a CFTDM está más afectada la función sarcomérica que la estructura en sí.[100] Trabajos recientes tratan de aclarar la aparente paradoja de que no exista una correlación clara entre la abundancia de bastones y la debilidad muscular. Parece ser que algunas mutaciones particulares son capaces de inducir una mayor tasa de apoptosis en las fibras musculares tipo II.[38]

De músculo liso
[editar]Existen dos isoformas que codifican actinas del músculo liso:
ACTG2 codifica la isoforma más larga de actina, con nueve exones, uno de ellos, el situado en el extremo 5', que no se traduce.[101] Se trata de una γ actina que se expresa en el músculo liso entérico. No se han encontrado mutaciones que se correspondan a patologías en este gen, aunque se ha visto mediante microarrays que es la proteína que, con diferencia, más aumenta su expresión en los casos de resistencia a la quimioterapia con cisplatino.[102]
ACTA2 codifica una α actina localizada en el músculo liso, y también en el músculo liso vascular. Se ha visto que una mutación, la MYH11, podría ser responsable de al menos un 14 % de los casos de aneurismas de aorta torácica hereditaria, concretamente el tipo 6, puesto que la variante mutada produce un mal ensamblaje de los filamentos y una reducción de la capacidad de contracción del músculo liso vascular. Se observa en estos individuos degeneración aórtica medial, con áreas de desorganización e hiperplasia, y estenosis de los vasa vasorum de la aorta.[103] El número de afecciones en las que podría estar implicado este gen está en aumento. Se le ha relacionado con la enfermedad de Moyamoya, y parece ser que algunas mutaciones en heterocigosis podrían conferir predisposición a muchas patologías vasculares, como el aneurisma de aorta torácica y la cardiopatía isquémica.[104] La α actina de músculo liso también es un interesante marcador para evaluar la progresión de la cirrosis hepática.[105]
De músculo cardíaco
[editar]ACTC1 es el gen que codifica la isoforma de la α actina presente en el músculo cardíaco. Se secuenció por primera vez por Hamada y colaboradores en 1982, observándose que estaba interrumpido por cinco intrones.[106] Fue el primer gen de los seis donde se encontraron alelos implicados en procesos patológicos.[107]

Se han descrito varios trastornos estructurales que conllevan una disfunción cardíaca asociados a mutaciones puntuales en este gen, como miocardiopatía dilatada tipo 1R y la miocardiopatía hipertrófica tipo 11. Recientemente, se ha visto que algunos defectos atriales septales también podrían estar relacionados.[109][110]
En el caso de la cardiomiopatía dilatada, se han estudiado dos casos en los que en ambos se produce una sustitución en aminoácidos muy conservados pertenecientes a los dominios que se unen a los discos Z e intercalados, todo lo cual lleva a la hipótesis de que la dilatación se produce por un defecto de trasmisión de la fuerza contráctil en los miocitos.[107][32]
Las alteraciones de ACTC1 son responsables de menos del 5 % de las cardiomiopatías hipertróficas.[111] Se han demostrado también la existencia de varias mutaciones puntuales:[112]
- Mutación E101K: cambios de carga neta y formación de enlace electrostático débil en la posición de unión de la actomiosina.
- P166A: zona de interacción entre monómeros de actina.
- A333P: zona de interacción actina-miosina.
La patogénesis parece obedecer a un mecanismo compensatorio: las proteínas mutantes actuarían como tóxico, con un efecto dominante, disminuyendo la capacidad de contracción con un rendimiento mecánico anormal, de modo que la hipertrofia, que suele ser tardía, sería consecuencia de una respuesta normal del músculo cardíaco al estrés.[113]
Recientemente se han encontrado mutaciones de ACTC1 implicadas en otros dos procesos patológicos: la miocardiopatía restrictiva idiopática infantil,[114] y el miocardio ventricular izquierdo no compacto.[115]
De actinas citoplasmáticas
[editar]ACTB es un locus muy complejo. Existen multitud de pseudogenes repartidos en todo el genoma, y su secuencia contiene seis exones que pueden dar lugar hasta 21 transcritos diferentes por splicing alternativo, conocidos como actinas β. En congruencia con esta complejidad, también sus productos tienen localizaciones y forman parte de procesos muy distintos (citoesqueleto, complejo NuA4 histona-aciltransferasa, núcleo celular) y por lo mismo también se le ha asociado al mecanismo de gran cantidad de procesos patológicos (carcinomas, distonía juvenil, mecanismos de infecciones, malformaciones en el sistema nervioso e invasividad de neoplasmas, entre otras).[116] Se ha encontrado una nueva forma de actina, la actina kappa, que parece sustituir a la actina β en procesos tumorales.[117]

Hasta el momento se han podido detectar tres procesos patológicos que se deben a una alteración directa de la secuencia de un gen:
- El hemangiopericitoma con translocación t(7;12)(p22;q13) es una afección rara, en la que se produce una fusión por translocación del gen ACTB sobre GLI1 en el cromosoma 12.[119]
- La distonía de debut juvenil es una enfermedad degenerativa rara, con afectación sistémica del sistema nervioso central, y especialmente de áreas neocorticales y talámicas, donde se pueden apreciar un tipo de inclusiones eosinofílicas en forma de bastón. Los individuos afectados presentan un fenotipo con malformaciones en la línea media, pérdida auditiva sensorial y distonía. Se deben a una mutación puntual que cambia el aminoácido arginina en posición 183 por un triptófano. Esto altera la interacción de la actina con el sistema ADF/cofilina, que regula la dinámica de formación del citoesqueleto neuronal.[120]
- Se ha encontrado una mutación puntual con carácter dominante que produce disfunción de los neutrófilos e infecciones recurrentes. Parece ser que la mutación modifica el dominio de unión con la profilina y otras proteínas reguladoras. La afinidad por la profilina en este alelo está muy reducida.[121]
ACTG1 es el locus que codifica la proteína de la γ actina citosólica responsable de la formación de microfilamentos del citoesqueleto. Contiene 6 exones, dando lugar a 22 mRNAs distintos, lo cual produce 4 isoformas completas, posiblemente expresadas de una forma dependiente de tejido. También tiene dos promotores alternativos.[122] Se ha visto que las secuencias traducidas de este locus y el de la β actina son más semejantes de lo esperado, sugiriendo una secuencia ancestral común que sufrió duplicación y conversión génica.[123]
Desde el punto de vista patológico, ha sido asociado a procesos como la amiloidosis, la retinitis pigmentosa, mecanismos de infección, enfermedades renales y diversas pérdidas auditivas congénitas.[122]
Relacionadas con seis mutaciones puntuales autosómico-dominantes en la secuencia, encontramos diversas formas de pérdidas de audición, en especial la sensorineural tipo 20/26. Parece que afectan de forma específica a los estereocilios de las células ciliadas del órgano de Corti. La β actina es la proteína más abundante en los tejidos humanos, pero no así en las células ciliadas, lo que explicaría la localización de la patología. Por otra parte, parece que la mayor parte de estas mutaciones afectan a zonas de unión con otras proteínas, en especial la actomiosina.[30] Algunos experimentos sugieren que el mecanismo patogénico de este tipo de sordera se debe a que la actina F de los mutantes sería más sensible de lo habitual a la cofilina.[124]
Por otra parte, aunque no se tiene constancia de ningún caso, se sabe que la γ actina también se expresa en el músculo esquelético, y aunque en cantidades muy pequeñas, los modelos animales han mostrado que su ausencia podría dar lugar a miopatías.[125]
Otros mecanismos patológicos
[editar]Algunos agentes infecciosos utilizan la actina, especialmente la citoplasmática, en su ciclo de vida. En bacterias básicamente existen dos formas:
- Listeria monocytogenes, algunas especies de Rickettsia, Shigella flexneri y otros gérmenes intracelulares escapan de las vacuolas fagocíticas mediante el recubrimiento con una cápsula corta de filamentos de actina. En el caso de L. monocytogenes y S. flexneri, generan a partir de ellos una estela en forma de «cola de cometa» que permite su movilidad. Existen ligeras diferencias en el mecanismo molecular de polimerización de la «cola en cometa» dependiendo de la especie bacteria. Se pueden observar distintas velocidades de desplazamiento, por ejemplo, con un máximo para Listeria y Shigella.[126] Muchos experimentos han ensayado este mecanismo in vitro. Estos muestran que no se emplea ninguna proteína motora tipo miosina, y parece que la propulsión se adquiere por la presión ejercida por la polimerización que tiene lugar cerca de la pared del microorganismo, que previamente se ha rodeado de ABP's propias de la célula hospedadora, que en su configuración mínima se trataría del complejo Arp2/3, proteínas Ena-VASP, cofilina, una proteína taponante y promotores de la nucleación, como el complejo de la vinculina. Mediante estos movimientos forman protrusiones que alcanzan las células vecinas, infectándolas a su vez, de modo que el sistema inmunológico solo puede combatir la infección mediante la inmunidad celular. La ruta del movimiento podría ser debida a la modificación de la curvatura y desramificación de los filamentos.[127] Otras especies, como Mycobacterium marinum y Burkholderia pseudomallei, también son capaces de polimerizar localmente la actina celular para facilitar su desplazamiento mediante un mecanismo que pivota sobre el complejo Arp2/3; más aún, el virus vacunal o Vaccinia virus también emplea elementos del citoesqueleto de actina para su diseminación.[128]
- Pseudomonas aeruginosa es capaz de formar un biofilm protector con el que escapa de las defensas del organismo, en especial de los neutrófilos y de los antibióticos, empleando ADN y filamentos de actina del hospedador.[129]
Además del ejemplo citado anteriormente, en los pasos iniciales de la internalización de algunos virus, notablemente el VIH, se estimula la polimerización de la actina, por ejemplo, inactivando la cofilina.[130]
En los procesos de invasión de las células cancerosas, las protrusiones basadas en actina desempeñan un papel aún no determinado.[131]
Evolución
[editar]El citoesqueleto eucariota muestra algunos componentes de gran semejanza a lo largo de la escala filogenética, especialmente la actina y la tubulina. Por ejemplo, la proteína codificada por el gen ACTG2 de humanos posee una equivalencia absoluta con los ortólogos presentes en rata y ratón, si bien a nivel de nucleótidos la identidad disminuye al 92 %.[132] No obstante, sí existen mayores diferencias con los equivalentes en procariotas (FtsZ y MreB), que, a su vez, presentan una identidad de secuencia de entre un 40-50 % entre las distintas especies de bacterias y arqueas. Algunos autores sugieren que la proteína ancestral que dio lugar al modelo básico de actina eucariota se asemeja a las proteínas del citoesqueleto bacteriano presentes en la actualidad.[133]

Algunos autores resaltan que la actina, la tubulina y las histonas, un tipo de proteínas implicadas en la estabilización y regulación del ADN, presentan similitudes en su capacidad de unir nucleótidos y en su funcionamiento basado en el aprovechamiento del movimiento browniano; más aún, sugieren que todos ellos podrían derivar de un ancestro común.[134] Por tanto, los mecanismos evolutivos diversificaron la proteína ancestral en las variantes hoy presentes, conservando, entre otras, las actinas como moléculas eficaces para abordar procesos biológicos antiguos y esenciales, como la endocitosis.[135]
Equivalentes en bacterias
[editar]Si bien las bacterias no tienen un citoesqueleto comparable en complejidad al de los eucariotas, se han descrito proteínas de alta similitud con los monómeros y polímeros de actina. La proteína MreB de bacterias polimeriza en filamentos delgados, no helicoidales y, raramente, en estructuras helicoidales semejantes a la actina F.[18] Más aún, su estructura cristalina es muy semejante a la actina G (en cuanto a conformación tridimensional), e incluso existen equivalencias entre los protofilamentos de MreB y la actina F. El citoesqueleto bacteriano también posee entre sus componentes las proteínas FtsZ, semejantes a la tubulina.[136]
Por tanto, las bacterias poseen un citoesqueleto con elementos homólogos a la actina (por ejemplo, MreB, ParM, y MamK), si bien la secuencia aminoacídica de estas proteínas diverge de las presentes en células animales. No obstante, MreB y ParM poseen una alta similitud estructural con la actina eucariota. Los microfilamentos, altamente dinámicos, generados mediante agregación de MreB y ParM son esenciales para la viabilidad celular y participan en la morfogénesis de la célula, segregación del genóforo y polaridad celular. ParM, un homólogo de la actina codificado en un plásmido, interviene en la gestión del ADN plasmídico.[137]
Aplicaciones
[editar]El aprovechamiento de la actina en los laboratorios de ciencia y tecnología derivan de su participación como riel de motores moleculares como la miosina (ya en el músculo, ya fuera de él), y de su presencia necesaria para el funcionamiento celular. En cuanto a la clínica, dado que algunas variantes anómalas de la actina están relacionadas con la aparición de patologías, su detección es un criterio diagnóstico.
- Nanotecnología. Los sistemas actina-miosina actúan como motores moleculares que permiten el transporte de vesículas y orgánulos a lo largo del citoplasma. Existen experimentos que aprovechan esta capacidad dinámica, incluso in vitro, es decir, en sistemas acelulares, por lo que se ha postulado una aplicación nanotecnológica del sistema. La idea subyacente es emplear los microfilamentos como rieles sobre los cuales una o más proteínas motoras se deslicen transportando una determinada carga; es decir, definir un circuito espacial por el que pueda transportarse de forma dirigida y más o menos controlada una determinada carga. En cuanto a aplicaciones generales, se habla del transporte dirigido de moléculas para lograr su liberación en lugares concretos, lo que permitiría al ensamblaje de nanoestructuras de forma controlada.[138] Estas capacidades podrían ser aplicadas en chips de investigación como los lab on a chip, en nanocomponentes mecánicos y en nanotransformadores de energía mecánica en eléctrica.[139]
- Control interno en técnicas de biología molecular, como el western blot y la PCR en tiempo real. Debido a que la función de la actina es necesaria para la supervivencia celular, se postuló que su cantidad está tan controlada a nivel de producción celular que puede asumirse que su transcripción (es decir, el grado de expresión de sus genes) y traducción, (que es la generación de proteína) es prácticamente constante, independientemente de las condiciones experimentales. Por esta razón, en los estudios de cuantificación de proteínas (western blot) y de transcritos (PCR en tiempo real) suele realizarse además de la cuantificación del gen de interés, la de un gen de referencia, como la mencionada actina. Dividiendo la cantidad del gen de interés por la de la actina es posible obtener una cantidad relativa comparable entre distintos experimentos,[140] siempre y cuando la expresión de esta última no varíe; cabe destacar que la actina no siempre presenta la estabilidad deseada en su expresión.[141]
- Clínica. Algunos alelos de la actina son causantes de patologías, por lo que se han desarrollado técnicas para su detección. Además, la actina puede emplearse como marcador indirecto en patología quirúrgica: es posible emplear variaciones en pauta de localización en los tejidos como marcadores de invasión de neoplasias, vasculitis y otros.[142] También, debido a su relación con el aparato contráctil muscular, la atrofia provoca la disminución de sus niveles en el músculo esquelético, por lo que puede emplearse como marcador de este fenómeno.[143]
- Tecnología de los alimentos. La determinación de la calidad de algunos alimentos procesados, como los embutidos, pasa por la cuantificación de su contenido en carne. Clásicamente, se ha utilizado un método basado en la detección de la 3-metilhistidina en hidrolizados de estos productos, pues se trata de un compuesto presente en la actina y la cadena pesada de la miosina F (ambos componentes mayoritarios del músculo). La generación en el animal del compuesto se debe a la metilación de residuos de histidina presentes en ambas proteínas.[144][145]
Véase también
[editar]Notas
[editar]- ↑ En este enlace [1] se observa un modelo de la prefoldina con la actina encajada entre los «tentáculos» de sus subunidades.
- ↑ En el siguiente enlace [2] de un trabajo de Jaime Martín-Benito y José María Valpuesta, del centro nacional de Biotecnología del CSIC, se puede apreciar la configuración en doble anillo de la chaperonina CCT, así como sus subunidades.
Referencias
[editar]- ↑ OMS,OPS,BIREME (ed.). «Actinas». Descriptores en Ciencias de la Salud. Biblioteca Virtual en Salud.
- ↑ Gunning P.W.; Ghoshdastider U,; Whitaker S.; Popp D.; Robinson R.C. (2015). «The evolution of compositionally and functionally distinct actin filaments». Journal of Cell Science 128 (11): 2009-19. PMID 25788699. doi:10.1242/jcs.165563.
- ↑ Ghoshdastider U.; Jiang S.; Popp D.; Robinson R.C. (2015). «In search of the primordial actin filament.». Proc Natl Acad Sci USA 112 (30): 9150-9151. PMID 26178194. doi:10.1073/pnas.1511568112.
- ↑ a b c d Marc Maillet Biología celular (en español). Publicado por Elsevier España, 2002; pág 132. ISBN 84-458-1105-3
- ↑ a b Alberts et al (2004). Biología molecular de la célula. Barcelona: Omega. ISBN 842821638X.
- ↑ Halliburton, W.D. (1887). «On muscle plasma». J. Physio. (8).
- ↑ Holmes, K.C.; Popp, D.; Gebhard, W.; Kabsch, W. (1990), «Atomic model of the actin filament», Nature 347 (6288): 44-49, doi:10.1038/347044a0.
- ↑ Szent-Gyorgyi, A. (1945) Studies on muscle. Acta Physiol Scandinav 9 (suplemento. 25)
- ↑ Straub, F.B.; Feuer, G. (1950). «Adenosinetriphosphate the functional group of actin.». Biochim.Biophys. Acta. PMID 2673365.
- ↑ Bárány, M.; Barron, J.T.; Gu, L.; Bárány, K. (2001). «Exchange of the actin-bound nucleotide in intact arterial smooth muscle». J. Biol. Chem. 276 (51). PMID 11602582.
- ↑ a b Elzinga, M.; Collins, J.H.; Kuehl, W.M.; Adelstein, R.S. (1973), «Complete amino-acid sequence of actin of rabbit skeletal muscle», Proceedings of the National Academy of Sciences 70 (9): 2687-2691, consultado el 29 de junio de 2009.
- ↑ a b Kabsch W.; Mannherz H.G.; Suck D.; Pai E.F.; Holmes K.C. (1990). «Atomic structure of the actin:DNase I complex.». Nature 347 (6288). PMID 2395459.
- ↑ Holmes K.C.; Popp D.; Gebhard W.; Kabsch W. (1990). «Atomic model of the actin filament». Nature 347 (6288). PMID 2395461.
- ↑ a b c d Domínguez, R.; Otterbein LR.; Graceffa P. (2001). The crystal structure of uncomplexed actin in the ADP state (en inglés) 293 (5530). pp. 708-11. PMID 11474115.
- ↑ Oriol, C.; Dubord, C.; Landon, F. (1977). «Crystallization of native striated-muscle actin». FEBS Lett. (en inglés) 73 (1): 89-91. PMID 320040.
- ↑ Sawaya M.R.; Kudryashov D.S.; Pashkov I.; Adisetiyo H.; Reisler E.; Yeates T.O. (2008). «Multiple crystal structures of actin dimers and their implications for interactions in the actin filament». Acta Crystallogr D Biol Crystallogr. (en inglés). PMID 18391412. Consultado el 10 de septiembre de 2024.
- ↑ Narita A.; Takeda S.; Yamashita A.; Maéda Y. (2006). «Structural basis of actin filament capping at the barbed-end: a cryo-electron microscopy study» (PDF). Embo J (en inglés) 25 (23): 5626-33. doi:10.1038/sj.emboj.7601395. Archivado desde el original el 19 de febrero de 2012. Consultado el 27 de junio de 2009.
- ↑ a b c d e f Toshiro Oda, Mitsusada Iwasa, Tomoki Aihara, Yuichiro Maéda y Akihiro Narita (2009): The nature of the globular- to fibrous-actin transition. Nature 457, 441-445 (22 January 2009) | doi:10.1038/nature07685
- ↑ Dominguez, Roberto; Holmes, Kenneth C. (2011). «Actin Structure and Function». Annu Rev Biophys. (en inglés) 40: 169-186. PMC 3130349. PMID 21314430. doi:10.1146/annurev-biophys-042910-155359. Consultado el 10 de septiembre de 2024.
- ↑ Steven Z. Choua; Thomas D. Pollard (2019). «Mechanism of actin polymerization revealed by cryo-EM structures of actin filaments with three different bound nucleotides». Proc Natl Acad Sci USA. (en inglés) 116 (10): 4265-4274. PMC 6410863. PMID 30760599. doi:10.1073/pnas.1807028115. Consultado el 10 de septiembre de 2024.
- ↑ Carman, Peter J.; Barrie, Kyle R.; Rebowski, Grzegorz; Dominguez, Roberto (2023). «Structures of the free and capped ends of the actin filament». Science (en inglés) 380 (6651): 1287-1292. PMC 10880383. PMID 37228182. doi:10.1126/science.adg6812. Consultado el 10 de septiembre de 2024.
- ↑ Ponte, P.; Gunning, P.; Blau, H.; Kedes, L. (1983), «Human actin genes are single copy for alpha-skeletal and alpha-cardiac actin but multicopy for β- and γ-cytoskeletal genes: 3' untranslated regions are isotype specific but are conserved in evolution», Molecular and Cellular Biology 3 (10): 1783-1791, archivado desde el original el 5 de febrero de 2009, consultado el 23 de noviembre de 2008.
- ↑ a b c d Lodish et al. (2005). Biología celular y molecular. Buenos Aires: Médica Panamericana. ISBN 9789500606264.
- ↑ Futoshi Hara; Kan Yamashiro; Naoki Nemoto; Yoshinori Ohta; Shin-ichi Yokobori; Takuo Yasunaga; Shin-ichi Hisanaga; Akihiko Yamagishi (2007). «An Actin Homolog of the Archaeon Thermoplasma acidophilum That Retains the Ancient Characteristics of Eukaryotic Actin». Journal of Bacteriology 189 (5): 2039-2045. doi:10.1128/JB.01454-06.
- ↑ a b Graceffa, Philip; Dominguez, Roberto (2003), «Crystal Structure of Monomeric Actin in the ATP State: STRUCTURAL BASIS OF NUCLEOTIDE-DEPENDENT ACTIN DYNAMICS», Journal of Biological Chemistry 278 (36): 34172-34180, PMID 12813032, doi:10.1074/jbc.M303689200, archivado desde el original el 10 de febrero de 2009, consultado el 23 de noviembre de 2008.
- ↑ Reisler, E. (1993), «Actin molecular structure and function», Curr Opin Cell Biol 5 (1): 41-47, doi:10.1016/S0955-0674(05)80006-7.
- ↑ «NCBI Conserved Domains: ATP binding site» (en inglés). Consultado el 26 de diciembre de 2008.
- ↑ a b Elzinga; Collins, J.H. (1975). «The primary structure of actin from rabbit skeletal muscle. Completion and analysis of the amino acid sequence». J Biol Chem. (en inglés) 250 (15).
- ↑ Elzinga, M.; Collins, J.H.; Kuehl, W.M.; Adelstein, R.S. (1973-09). «Complete amino-acid sequence of actin of rabbit skeletal muscle». Proceedings of the National Academy of Sciences of the United States of America 70 (9): 2687-2691. ISSN 0027-8424. PMID 4517681. doi:10.1073/pnas.70.9.2687. Consultado el 9 de marzo de 2023.
- ↑ a b c d e f g h dos Remedios, Cristobal G.; Chhabra, Deepak (8 de enero de 2008). Actin-Binding Proteins and Disease (en inglés). Australia: Springer Science & Business Media. ISBN 978-0-387-71749-4. Consultado el 9 de marzo de 2023.
- ↑ Rould; Wan Q.; Joel P.B.; Lowey S.; Trybus K.M. (2006). «Crystal structures of expressed non-polymerizable monomeric actin in the ADP and ATP states». J Biol chem 281 (42). doi:10.1074/jbc.M601973200. Archivado desde el original el 25 de septiembre de 2019. Consultado el 11 de julio de 2009.
- ↑ a b Devlin, Thomas M. (2004). «23». Bioquímica: Libro de texto con aplicaciones clínicas (en inglés) (4 edición). Reverte. p. 1021. ISBN 8429172084..
- ↑ a b c Egelman; Reisler, E. (2007). «Actin structure and function: what we still do not understand». J Biol Chem 282 (50). doi:10.1074/jbc.R700030200. Archivado desde el original el 25 de mayo de 2009. Consultado el 12 de julio de 2009.
- ↑ DA Begg, R Rodewald y LI Rebhun (1978): The visualization of actin filament polarity in thin sections. Evidence for the uniform polarity of membrane-associated filaments. The Journal of Cell Biology, Vol 79, 846-852.
- ↑ a b c Arthur C. Guyton, John E. Hall Tratado de fisiología médica (en español). Publicado por Elsevier España, 2007; pág 76. ISBN 84-8174-926-5
- ↑ a b Simons, C.T.; Staes A.; Rommelaere H.; Ampe C.; Lewis S.A.; Cowan N.J. (2004). «Selective contribution of eukaryotic prefoldin subunits to actin and tubulin binding». J Biol Chem. (en inglés) 279 (6): 4196-4203. PMID 14634002. doi:10.1074/jbc.M306053200. Archivado desde el original el 25 de septiembre de 2019. Consultado el 8 de julio de 2009.
- ↑ Martín-Benito; Boskovic J.; Gómez-Puertas P.; Carrascosa JL.; Simons CT.; Lewis SA.; Bartolini F.; Cowan NJ. et al. (2002). «Structure of eukaryotic prefoldin and of its complexes with unfolded actin and the cytosolic chaperonin CCT». EMBO J (en inglés) 21 (23): 6377-86. PMID 12456645. doi:10.1093/emboj/cdf640.
- ↑ a b Vandamme, D; Lambert E, Waterschoot D, Cognard C, Vandekerckhove J, Ampe C, Constantin B, Rommelaere H. (julio de 2009). «alpha-Skeletal muscle actin nemaline myopathy mutants cause cell death in cultured muscle cells». Biochim Biophys Acta. (en inglés) 1793 (7): 1259-71. PMID 19393268.
- ↑ a b Brackley; Grantham J. (2009). «Activities of the chaperonin containing TCP-1 (CCT): implications for cell cycle progression and cytoskeletal organisation». Cell Stress Chaperones (en inglés) 14 (1): 23-31. PMID 18595008. doi:10.1007/s12192-008-0057-x.
- ↑ a b Stirling, P.C.; Cuéllar J.; Alfaro G.A.; El Khadali F.; Beh C.T.; Valpuesta J.M.; Melki R.; Leroux M.R. (2006). «PhLP3 modulates CCT-mediated actin and tubulin folding via ternary complexes with substrates». J Biol Chem (en inglés) 281 (11): 7012-21. PMID 16415341. doi:10.1074/jbc.M513235200. Archivado desde el original el 25 de septiembre de 2019. Consultado el 8 de julio de 2009.
- ↑ Hansen, W.J.; Cowan N.J.; Welch W.J. (1999). «Prefoldin-nascent chain complexes in the folding of cytoskeletal proteins». J Cell Biol. (en inglés) (265-7) (145): 2. PMID 10209023.
- ↑ Neirynck; Waterschoot D.; Vandekerckhove J.; Ampe C.; Rommelaere H. (2006). «Actin interacts with CCT via discrete binding sites: a binding transition-release model for CCT-mediated actin folding». J Mol Biol. 355 (1): 124-38. PMID 16300788.
- ↑ a b c Vavylonis, D.; Yang Q.; O'Shaughnessy B. (2005). «Actin polymerization kinetics, cap structure, and fluctuations». Proc Natl Acad Sci U S A. (en inglés) 102 (24): 8543-8. PMID 15939882. doi:10.1073/pnas.0501435102.
- ↑ Kawamura, M.; Maruyama, K. (1970), «Electron Microscopic Particle Length of F-Actin Polymerized in Vitro», Journal of Biochemistry 67 (3): 437.
- ↑ Cooper, Geoffrey M.; Robert E.; Hausman (2007). «Chapter 12: The Cytoskeleton and Cell Movement». The cell: a molecular approach (en inglés). ASM Press, Washington. ISBN 0-87893-219-4.
- ↑ «Tabla de las constantes de asociación y disociación de las diferentes especies de monómeros al filamento de actina, según la literatura científica.».
- ↑ Kirschner, M.W. (1980), «Implications of treadmilling for the stability and polarity of actin and tubulin polymers in vivo» (pdf), The Journal of Cell Biology 86 (1): 330-334, PMID 6893454, doi:10.1083/jcb.86.1.330.
- ↑ Lewin, Benjamin (2006). Cells (Google books) (en inglés). Jones & Bartlett Publishers. ISBN 978-0-7637-3905-8.
- ↑ Zhang, Duan-Sun; Piazza, Valeria; Perrin, Benjamin J.; Rzadzinska, Agnieszka K.; Poczatek, J. Collin; Wang, Mei; Prosser, Haydn M.; Ervasti, James M.; Corey, David P.; Lechene, Claude P. (15 de enero de 2012). «Multi-isotope imaging mass spectrometry reveals slow protein turnover in hair-cell stereocilia». Nature (en inglés) 481 (7382): 520-524. doi:10.1038/nature10745. Consultado el 27 de enero de 2012.
- ↑ THE STRUCTURE OF CRYSTALLINE PROFILIN-BETA-ACTIN Protein Data Bank
- ↑ Domínguez, R. (2004). Actin-binding proteins--a unifying hypothesis. 29 (11). pp. 572-8. PMID 15501675.
- ↑ Goldschmidt-clermont, P.J.; Furman, M.I.; Wachsstock, D.; Safer, D.; Nachmias, V.T.; Pollard, T.D. (1992), «The control of actin nucleotide exchange by thymosin β 4 and profilin. A potential regulatory mechanism for actin polymerization in cells», Molecular Biology of the Cell 3 (9): 1015-1024.
- ↑ Witke, W., Podtelejnikov, A., Di Nardo, A., Sutherland, J., Gurniak, C., Dotti, C., and M. Mann (1998) In Mouse Brain Profilin I and Profilin II Associate With Regulators of the Endocytic Pathway and Actin Assembly. The EMBO Journal 17(4): 967-976 Entrez PubMed 9463375
- ↑ Carlsson L, Nyström LE, Sundkvist I, Markey F, Lindberg U. (1977) Actin polymerizability is influenced by profilin, a low molecular weight protein in non-muscle cells. J. Mol. Biol. 115:465-483 Entrez PubMed 563468
- ↑ Kiselar, J., Janmey, P., Almo, S., Chance, M. (2003). «Visualizing the Ca2+-dependent activation of gelsolin by using synchrotron footprinting». PNAS 100 (7): 3942-3947. PMID 12655044. doi:10.1073/pnas.0736004100.
- ↑ Southwick, Frederick S. (2000), «Gelsolin and ADF/cofilin enhance the actin dynamics of motile cells», Proceedings of the National Academy of Sciences of the United States of America 97 (13): 6936, PMID 10860951, doi:10.1073/pnas.97.13.6936, archivado desde el original el 25 de septiembre de 2019, consultado el 23 de noviembre de 2008.
- ↑ Caldwell, J.E.; Heiss, S.G.; Mermall, V.; Cooper, J.A. (1989), «Effects of CapZ, an actin-capping protein of muscle, on the polymerization of actin» (w), Biochemistry 28 (21): 8506-8514, doi:10.1021/bi00447a036.
- ↑ Weber, A.; Pennise, C.R.; Babcock, G.G.; Fowler, V.M. (1994), «Tropomodulin caps the pointed ends of actin filaments», The Journal of Cell Biology 127 (6): 1627-1635, PMID 7798317, doi:10.1083/jcb.127.6.1627.
- ↑ Robinson RC, Turbedsky K, Kaiser DA, Marchand JB, Higgs HN, Choe S, Pollard TD. (2001) Crystal structure of Arp2/3 complex (en inglés). Science 294(5547):1679-84.
- ↑ Mullins, R.D.; Pollard, T.D. (abril de 1999). «Structure and function of the Arp2/3 complex». Current Opinion in Structural Biology (Elsevier) 9 (2): 244-249. doi:10.1016/S0959-440X(99)80034-7. Archivado desde el original el 7 de noviembre de 2014. Consultado el 3 de octubre de 2007.
- ↑ Laura M Machesky; Kathleen L Gould (Febrero de 1999). «The Arp2/3 complex: a multifunctional actin organizer». Current Opinion in Cell Biology 11 (1): 117-121. doi:10.1016/S0955-0674(99)80014-3. Archivado desde el original el 5 de julio de 2009.
- ↑ Morton, W.M.; Ayscough, K.R.; McLaughlin, P.J. (2000), «Latrunculin alters the actin-monomer subunit interface to prevent polymerization», Nature Cell Biology 2 (6): 376-378, doi:10.1038/35014075.
- ↑ a b Cooper, J.A. (1987), «Effects of cytochalasin and phalloidin on actin», The Journal of Cell Biology 105 (4): 1473-1478, doi:10.1083/jcb.105.4.1473.
- ↑ Rubtsova, S.N.; Kondratov, R.V.; Kopnin, P.B.; Chumakov, P.M.; Kopnin, B.P.; Vasiliev, J.M. (1998), «Disruption of actin microfilaments by cytochalasin D leads to activation of p53», FEBS Letters 430 (3): 353-357, doi:10.1016/S0014-5793(98)00692-9.
- ↑ Staves, M.P.; Wayne, R.; Leopold, A.C. (1997), «Cytochalasin D does not inhibit gravitropism in roots», American Journal of Botany 84 (11): 1530-1530, doi:10.2307/2446614.
- ↑ a b Grummt, I (2006), «Actin and myosin as transcription factors» (w), Current opinion in genetics & development 16 (2): 191-196, doi:10.1016/j.gde.2006.02.001, archivado desde el original el 30 de junio de 2018, consultado el 13 de marzo de 2009.
- ↑ M.V. Wakelam, T.R. Insall (2005), «Phospholipase D activity is essential for actin localization and actin-based motility in Dictyostelium» (w), Biochemical Journal 389 (Pt 1): 207, doi:10.1042/BJ20050085.
- ↑ Randall, D.; Burggren, W. et French, K. Eckert Fisiología animal (4.ª edición). ISBN 84-486-0200-5.
- ↑ Pujol-Moix (2001). Trombocitopenias (2da edición). Elsevier, España. p. 25. ISBN 8481745952.
- ↑ a b c Paniagua, R.; Nistal, M.; Sesma, P.; Álvarez-Uría, M.; Fraile, B.; Anadón, R. y José Sáez, F. (2002). Citología e histología vegetal y animal. McGraw-Hill Interamericana de España, S.A.U. ISBN 84-486-0436-9.
- ↑ a b Moseley, James B.; Goode, Bruce L. (2006), «The Yeast Actin Cytoskeleton: from Cellular Function to Biochemical Mechanism», Microbiology and Molecular Biology Reviews 70 (3): 605-645, PMID 16959963, doi:10.1128/MMBR.00013-06.
- ↑ Meagher, R.B.; McKinney, E.C.; Kandasamy, M.K. (1999), «Isovariant Dynamics Expand and Buffer the Responses of Complex Systems: The Diverse Plant Actin Gene Family», The Plant Cell Online 11 (6): 995-1006.
- ↑ Entrada PDBe para 1unc. EBI.
- ↑ a b Higaki, Takumi; Sano, Toshio; Hasezawa, Seiichiro (Diciembre de 2007). «Actin microfilament dynamics and actin side-binding proteins in plants». Current Opinion in Plant Biology 10 (6): 549-556. ISSN 1369-5266. PMID 17936064. doi:10.1016/j.pbi.2007.08.012. Consultado el 9 de marzo de 2023.
- ↑ Kovar, D.R.; Staiger, C.J.; Weaver, E.A.; McCurdy, D.W. (2000), «AtFim1 is an actin filament crosslinking protein from Arabidopsis thaliana», The Plant Journal 24 (5): 625-636, doi:10.1046/j.1365-313x.2000.00907.x.
- ↑ Antonio Bayés de Luna, VV Staff, José López-Sendón, Fause Attie, Eduardo Alegría Ezquerra Cardiología Clínica (en español). Publicado por Elsevier España, 2002; pag pág 19. ISBN 84-458-1179-7
- ↑ a b John W. Baynes, Marek H. Dominiczak Bioquímica médica (en español). Publicado por Elsevier España, 2007; pág 268. ISBN 84-8174-866-8
- ↑ Randall, D.; Burggren, W.; French, K. Eckert Fisiología animal (4.ª edición). ISBN 84-486-0200-5.
- ↑ Fujiwara, K.; Porter, M.E.; Pollard, T.D. (1978), «Alpha-actinin localization in the cleavage furrow during cytokinesis», The Journal of Cell Biology 79 (1): 268-275, PMID 359574, doi:10.1083/jcb.79.1.268.
- ↑ Pelham, R.J.; Chang, F. (2002), «Actin dynamics in the contractile ring during cytokinesis in fission yeast», Nature 419 (6902): 82-86.
- ↑ Mashima, T.; Naito, M.; Noguchi, K.; Miller, D.K.; Nicholson, D.W.; Tsuruo, T. (1997), «Actin cleavage by CPP-32/apopain during the development of apoptosis» (w), Oncogene 14 (9): 1007-1012, doi:10.1038/sj.onc.1200919.
- ↑ Wang, K. K. (Enero de 2000). «Calpain and caspase: can you tell the difference?». Trends in Neurosciences 23 (1): 20-26. ISSN 0166-2236. PMID 10631785. doi:10.1016/s0166-2236(99)01479-4. Consultado el 9 de marzo de 2023.
- ↑ Villa, P.G.; Henzel, W.J.; Sensenbrenner, M.; Henderson, C.E.; Pettmann, B. (Marzo de 1998). «Calpain inhibitors, but not caspase inhibitors, prevent actin proteolysis and DNA fragmentation during apoptosis». Journal of Cell Science. 111 ( Pt 6): 713-722. ISSN 0021-9533. PMID 9472000. doi:10.1242/jcs.111.6.713. Consultado el 9 de marzo de 2023.
- ↑ Huot, J.; Houle, F.; Rousseau, S.; Deschesnes, R.G.; Shah, G.M.; Landry, J. (1998), «SAPK2/p38-dependent F-Actin Reorganization Regulates Early Membrane Blebbing during Stress-induced Apoptosis», The Journal of Cell Biology 143 (5): 1361-1373.
- ↑ Adams, C.L.; Nelson, W.J.; Smith, S.J. (1996), «Quantitative analysis of cadherin-catenin-actin reorganization during development of cell-cell adhesion» (w), The Journal of Cell Biology 135 (6): 1899-1911, PMID 8991100, doi:10.1083/jcb.135.6.1899.
- ↑ Witke, W.; Schleicher, M.; Noegel, A.A. (1992), «Redundancy in the microfilament system: abnormal development of Dictyostelium cells lacking two F-actin cross-linking proteins», Cell 68 (1): 53-62.
- ↑ Fernandez-valle, C.; Gorman, D.; Gomez, A.M.; Bunge, M.B. (1997), «Actin Plays a Role in Both Changes in Cell Shape and Gene- Expression Associated with Schwann Cell Myelination», Journal of Neuroscience 17 (1): 241-250.
- ↑ Wolyniak, Michael J.; Sundstrom, Paula (2007), «Role of Actin Cytoskeletal Dynamics in Activation of the Cyclic AMP Pathway and HWP1 Gene Expression in Candida albicans», Eukaryotic Cell 6 (10): 1824-1840, PMID 17715368, doi:10.1128/EC.00188-07.
- ↑ Tanaka, Hiromitsu; Iguchi, Naoko; Egydio de Carvalho, Carlos; Tadokoro, Yuko; Yomogida, Kentaro; Nishimune, Yoshitake (Agosto de 2003). «Novel actin-like proteins T-ACTIN 1 and T-ACTIN 2 are differentially expressed in the cytoplasm and nucleus of mouse haploid germ cells». Biology of Reproduction 69 (2): 475-482. ISSN 0006-3363. PMID 12672658. doi:10.1095/biolreprod.103.015867. Consultado el 9 de marzo de 2023.
- ↑ Jiang, Y.W.; Stillman, D.J. (1996), «Epigenetic effects on yeast transcription caused by mutations in an actin-related protein present in the nucleus» (w), Genes & Development 10 (5): 604-619, doi:10.1101/gad.10.5.604.
- ↑ Manor, U.; Kachar, B. (2008), «Dynamic length regulation of sensory stereocilia», Seminars in Cell and Developmental Biology 19 (6): 502-510, archivado desde el original el 30 de enero de 2018, consultado el 20 de junio de 2009.
- ↑ Rzadzinska, A.K.; Schneider, M.E.; Davies, C.; Riordan, G.P.; Kachar, B. (2004), «An actin molecular treadmill and myosins maintain stereocilia functional architecture and self-», Journal of Cell Biology 164 (6): 887-897, consultado el 20 de junio de 2009.
- ↑ Su AI, Wiltshire T, Batalov S, Lapp H, Ching KA, Block D, Zhang J, Soden R, Hayakawa M, Kreiman G, Cooke MP, Walker JR, Hogenesch JB (2004). «A gene atlas of the mouse and human protein-encoding transcriptomes». Proc Natl Acad Sci U S A. 101 (16). PMID 15075390. Archivado desde el original el 15 de octubre de 2018. Consultado el 29 de diciembre de 2008.
- ↑ a b «Uniprot ACTA1» (en inglés). Consultado el 26 de diciembre de 2008.
- ↑ a b Friederike S Bathe, Heidi Rommelaere y Laura M Machesky (2007): Phenotypes of Myopathy-related Actin Mutants in differentiated C2C12 Myotubes. BMC Cell Biology, 8:2. doi:10.1186/1471-2121-8-2
- ↑ Kaindl AM, Rüschendorf F, Krause S, Goebel HH, Koehler K, Becker C, Pongratz D, Müller-Höcker J, Nürnberg P, Stoltenburg-Didinger G, Lochmüller H, Huebner A. (2004). «Missense mutations of ACTA1 cause dominant congenital myopathy with cores». J Med Genet. 41 (11). PMID 15520409.
- ↑ Sparrow, JC.; Nowak KJ.; Durling HJ.; Beggs AH.; Wallgren-Pettersson C.; Romero N.; Nonaka I.; Laing NG. (septiembre de 2003). «Muscle disease caused by mutations in the skeletal muscle alpha-actin gene (ACTA1)». Neuromuscul Disord. 13 (8): 519-31. PMID 12921789.
- ↑ North, Kathryn (2002). «Nemaline Myopathy». Gene Reviews. PMID.
- ↑ Ilkovski B, Nowak KJ, Domazetovska A, Maxwell AL, Clement S, Davies KE, Laing NG, North KN, Cooper ST. (2004). «Evidence for a dominant-negative effect in ACTA1 nemaline myopathy caused by abnormal folding, aggregation and altered polymerization of mutant actin isoforms». Hum. Mol. Genet. 13 (16). PMID 15198992.
- ↑ Clarke NF, Ilkovski B, Cooper S, Valova VA, Robinson PJ, Nonaka I, Feng JJ, Marston S, North K (2007). «The pathogenesis of ACTA1-related congenital fiber type disproportion». Ann Neurol 61 (6). PMID 17387733.
- ↑ «Structure, chromosome location, and expression of the human smooth muscle (enteric type) γ-actin gene: evolution of six human actin genes». Mol Cell Biol. 11 (6). 1991. PMID 1710027.
- ↑ Watson MB, Lind MJ, Smith L, Drew PJ, Cawkwell L. (2007). «Expression microarray analysis reveals genes associated with in vitro resistance to cisplatin in a cell line model». Acta Oncol. 46 (5). PMID 17562441.
- ↑ Guo, D. C.; Pannu, H.; Tran-Fadulu, V.; Papke, C. L.; Yu, R. K.; Avidan, N.; Bourgeois, S.; Estrera, A. L. et al. (2007). «Mutations in smooth muscle alpha-actin (ACTA2) lead to thoracic aortic aneurysms and dissections». Nature Genet. 39 (12). PMID 17994018. doi:10.1038/ng.2007.6.
- ↑ Guo, D. C.; Papke, C. L.; Tran-Fadulu, V.; Regalado, E. S.; Avidan, N.; Johnson, R. J.; Kim, D. H.; Pannu, H. et al. (mayo de 2009). «Mutations in smooth muscle alpha-actin (ACTA2) cause coronary artery disease, stroke, and Moyamoya disease, along with thoracic aortic disease». Am J Human Genet (en inglés) 84 (5): 617-27. PMC 2680995. PMID 19409525. doi:10.1016/j.ajhg.2009.04.007.
- ↑ Akpolat N, Yahsi S, Godekmerdan A, Yalniz M, Demirbag K (2005). «The value of alpha-SMA in the evaluation of hepatic fibrosis severity in hepatitis B infection and cirrhosis development: a histopathological and immunohistochemical study». Histopathology 47 (3). PMID 16115228.
- ↑ Hamada H, Petrino MG, Kakunaga T. (1982). «Molecular structure and evolutionary origin of human cardiac muscle actin gene». Proc Natl Acad Sci U S A. 79 (19). PMID 6310553.
- ↑ a b Olson TM, Michels VV, Thibodeau SN, Tai YS, Keating MT. (1998). «Actin mutations in dilated cardiomyopathy, a heritable form of heart failure.». Science 280 (5364). PMID 9563954.
- ↑ Xia X-G, Zhou H, Samper E, Melov S, Xu Z (2006) Pol II-Expressed shRNA Knocks Down Sod2 Gene Expression and Causes Phenotypes of the Gene Knockout in Mice. PLoS Genet 2(1): e10. doi:10.1371/journal.pgen.0020010
- ↑ «Entry - *102540 - ACTIN, ALPHA, CARDIAC MUSCLE; ACTC1 - OMIM». www.omim.org (en inglés estadounidense). Consultado el 9 de marzo de 2023.
- ↑ Matsson H, Eason J, Bookwalter CS, Klar J, Gustavsson P, Sunnegårdh J, Enell H, Jonzon A, Vikkula M, Gutiérrez I, Granados-Riveron J, Pope M, Bu'Lock F, Cox J, Robinson TE, Song F, Brook DJ, Marston S, Trybus KM, Dahl N. (2008). «Alpha-cardiac actin mutations produce atrial septal defects.». Hum Mol Genet. 17 (2). PMID 17947298.
- ↑ Kabaeva, Kabaeva,Z (enero de 2003). «Genetic analysis in hypertrophic cardiomyopathy: missense mutations in the ventricular myosin regulatory light chain gene» (Disertación) (en inglés). Universidad Humboldt de Berlín. Consultado el 27 de diciembre de 2008.
- ↑ Olson TM, Doan TP, Kishimoto NY, Whitby FG, Ackerman MJ, Fananapazir L. Inherited and de novo mutations in the cardiac actin gene cause hypertrophic cardiomyopathy (en inglés). J Mol Cell Cardiol 2000; 32:1687-1694.
- ↑ Ramírez, Carlos Darío; Raúl Padrón (marzo de 2004). «Cardiomiopatía hipertrófica familiar: Genes, mutaciones y modelos animales. Revisión.». Invest. clín, mar. 2004, vol.45, no.1, p.69-100. Consultado el 15 de julio de 2009.
- ↑ Kaski JP, Syrris P, Burch M, Tomé-Esteban MT, Fenton M, Christiansen M, Andersen PS, Sebire N, Ashworth M, Deanfield JE, McKenna WJ, Elliott PM. (2008). «Idiopathic restrictive cardiomyopathy in children is caused by mutations in cardiac sarcomere protein genes». Heart 94 (11). PMID 18467357.
- ↑ Klaassen S, Probst S, Oechslin E, Gerull B, Krings G, Schuler P, Greutmann M, Hürlimann D, Yegitbasi M, Pons L, Gramlich M, Drenckhahn JD, Heuser A, Berger F, Jenni R, Thierfelder L. (2008). «Mutations in sarcomere protein genes in left ventricular noncompaction». Circulation 117 (22). PMID 1850600.
- ↑ «ACEVieW:Homo sapiens complex locus ACTB, encoding actin, β.» (en inglés). Consultado el 28 de junio de 2008.
- ↑ Chang KW, Yang PY, Lai HY, Yeh TS, Chen TC, Yeh CT. (2006). «Identification of a novel actin isoform in hepatocellular carcinoma». Hepatol Res. 36 (1). PMID 16824795.
- ↑ Kristy L Williams, Masuma Rahimtula yKaren M Mearow. Hsp27 and axonal growth in adult sensory neurons in vitro BMC Neuroscience 2005, 6:24doi:10.1186/1471-2202-6-24
- ↑ «Pericytoma with t(7;12)». Atlas of Genetics and Cytogenetics in Oncology and Haematology. Consultado el 28 de diciembre de 2008.
- ↑ Procaccio V, Salazar G, Ono S, Styers ML, Gearing M, Dávila A, Jiménez R, Juncos J, Gutekunst CA, Meroni G, Fontanella B, Sontag E, Sontag JM, Faundez V, Wainer BH. (2006). «A mutation of β -actin that alters depolymerization dynamics is associated with autosomal dominant developmental malformations, deafness, and dystonia». Am J Hum Genet 78 (6). PMID 16685646.
- ↑ Nunoi H, Yamazaki T, Tsuchiya H, Kato S, Malech HL, Matsuda I, Kanegasaki S. (1999). «A heterozygous mutation of β-actin associated with neutrophil dysfunction and recurrent infection». Proc Natl Acad Sci U S A. 96 (15). PMID 10411937.
- ↑ a b «ACEVIEW ACTG1» (en inglés). Consultado el 29 de diciembre de 2008.
- ↑ Erba HP, Gunning P, Kedes L. (1986). «Nucleotide sequence of the human γ cytoskeletal actin mRNA: anomalous evolution of vertebrate non-muscle actin genes.». Nucleic Acids Res. 14 (13). PMID 373740.
- ↑ Bryan, KE; Rubenstein, PA (julio de 2009). «Allele-specific Effects of Human Deafness {γ}-Actin Mutations (DFNA20/26) on the Actin/Cofilin Interaction». J Biol Chem. (en inglés) 284 (27): 18260-9. PMID 19419963.
- ↑ Sonnemann KJ, Fitzsimons DP, Patel JR, Liu Y, Schneider MF, Moss RL, Ervasti JM. (2006). «Cytoplasmic γ-actin is not required for skeletal muscle development but its absence leads to a progressive myopathy.». Dev Cell 11 (3). PMID 16950128.
- ↑ Gouin, E. (1999), «A comparative study of the actin-based motilities of the pathogenic bacteria Listeria monocytogenes, Shigella flexneriand Rickettsia conorii» (w), Journal of Cell Science 112 (11): 1697-1708.
- ↑ Lambrechts, A; Gevaert K, Cossart P, Vandekerckhove J, Van Troys M. (mayo de 2008). «Listeria comet tails: the actin-based motility machinery at work». Trends Cell Biol. (en inglés) 18 (5): 220-7. PMID 18396046.
- ↑ Gouin, E.; Welch, M.D.; Cossart, P. (2005), «Actin-based motility of intracellular pathogens», Current Opinion in Microbiology 8 (1): 35-45, archivado desde el original el 30 de enero de 2018.
- ↑ Parks, QM; Young RL, Poch KR, Malcolm KC, Vasil ML, Nick JA. (abril de 2009). «Neutrophil enhancement of Pseudomonas aeruginosa biofilm development: human F-actin and DNA as targets for therapy». J med microbiol: 492-502 pmid=19273646. doi:10.1099/jmm.0.005728-0.
- ↑ Liu; Belkina NV, Shaw S. (abril de 2009). «HIV infection of T cells: actin-in and actin-out». Sci Signal. (en inglés) 2. PMID 19366992.
- ↑ Machesky LM; Tang HR (julio de 2009). «Actin-Based Protrusions: Promoters or Inhibitors of Cancer Invasion?». Cancer Cell. 16 (1): 5-7. PMID 19573806.
- ↑ Miwa, T. Manabe (1991), «The nucleotide sequence of a human smooth muscle (enteric type) γ-actin cDNA.», Molecular and Cellular Biology 11 (6): 3296-3306.
- ↑ Erickson, H.P (2007), «Evolution of the cytoskeleton», BioEssays: news and reviews in molecular, cellular and developmental biology 29 (7): 668.
- ↑ Gardiner, J (2008), «Are histones, tubulin, and actin derived from a common ancestral protein?», Protoplasma 233: 1, doi:10.1007/s00709-008-0305-z.
- ↑ Brian J. Galletta; John A. Cooper (2009), «Actin and endocytosis: mechanisms and phylogeny», Current Opinion in Cell Biology 21: 20, doi:10.1016/j.ceb.2009.01.0, archivado desde el original el 14 de junio de 2018, consultado el 16 de marzo de 2009.
- ↑ Van Den Ent, F.; Amos, L.A.; Löwe, J. (2001), «Prokaryotic origin of the actin cytoskeleton» (w), Nature 413: 39-44, doi:10.1038/35092500, archivado desde el original el 18 de abril de 2007, consultado el 23 de noviembre de 2008.
- ↑ Carballido-lopez, Rut (2006), «The Bacterial Actin-Like Cytoskeleton» (w), Microbiology and Molecular Biology Reviews 70 (4): 888-909, PMID 17158703, doi:10.1128/MMBR.00014-06.
- ↑ Henry Hess; John Clemmens; Dong Qin; Jonathon Howard; Viola Vogel (2001), «Light-controlled molecular shuttles made from motor proteins carrying cargo on engineered surfaces», Nano Letters 1 (5): 235-239, doi:10.1021/nl015521e.
- ↑ Mansson, A. Sundberg (2005), «Actin-Based Molecular Motors for Cargo Transportation in Nanotechnology—Potentials and Challenges», IEEE Transactions on Advanced Packaging 28 (4): 547-555.
- ↑ Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, Speleman F (2002) Accurate normalisation of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes Archivado el 27 de mayo de 2020 en Wayback Machine.. Gen. Biol. 3: 1-12.
- ↑ Selvey, S.; Thompson, E.W.; Matthaei, K.; Lea, R.A.; Irving, M.G.; Griffiths, L.R. (2001), «ß-Actin», Molecular and cellular Probes 15 (5): 307-311, archivado desde el original el 4 de junio de 2018, consultado el 7 de julio de 2009.
- ↑ Mukai, K.; Schollmeyer, J.V.; Rosai, J. (1981), «Immunohistochemical localization of actin: Applications in surgical pathology.», The American Journal of Surgical Pathology 5 (1): 91, consultado el 19 de abril de 2009.
- ↑ Haddad, F.; Roy, R.R.; Zhong, H.; Edgerton, V.R.; Baldwin, K.M. (2003), «Atrophy responses to muscle inactivity. II. Molecular markers of protein deficits», Journal of Applied Physiology 95 (2): 791-802, consultado el 19 de marzo de 2009.
- ↑ Remignon, H.; Molette, C.; Babile, R.; Fernandez, X. (2006), «Current advances in proteomic analysis and its use for the resolution of poultry meat quality», World's Poultry Science Journal 62 (01): 123-130, archivado desde el original el 7 de noviembre de 2014, consultado el 7 de julio de 2009.
- ↑ M.L. (2004), «Methods and Instruments in Applied Food Analysis», Handbook of Food Analysis., archivado desde el original el 12 de agosto de 2016, consultado el 7 de julio de 2009.
Enlaces externos
[editar] Wikimedia Commons alberga una categoría multimedia sobre Actina.
Wikimedia Commons alberga una categoría multimedia sobre Actina.- Vídeo de la polimerización de la actina (en inglés)
- Vídeo de la interacción actina-miosina (en inglés)
- MMDB ID 50538 Modelo molecular de G-actina unida a ATP por Domínguez.
- MMDB ID 69126 Modelo molecular de F actina por T. Oda
 KSF
KSF