Biosíntesis
 From Wikipedia (Es) - Reading time: 27 min
From Wikipedia (Es) - Reading time: 27 min
La biosíntesis es un proceso de múltiples pasos, catalizado por enzimas, en el que los sustratos se convierten en productos más complejos en los organismos vivos. En la biosíntesis, los compuestos simples se modifican, se convierten en otros compuestos o se unen para formar macromoléculas. Este proceso a menudo consiste en vías metabólicas. Algunas de estas vías biosintéticas se ubican dentro de un solo orgánulo celular, mientras que otras involucran enzimas que se ubican dentro de múltiples orgánulos celulares. Ejemplos de estas rutas biosintéticas incluyen la producción de componentes de membrana lipídica y nucleótidos. La biosíntesis suele ser sinónimo de anabolismo.
Los elementos necesarios para la biosíntesis incluyen: compuestos precursores, energía química (por ejemplo, ATP), y enzimas catalíticas que pueden requerir coenzimas (por ejemplo, NADH, NADPH). Estos elementos crean monómeros, los bloques de construcción para macromoléculas. Algunas macromoléculas biológicas importantes incluyen: proteínas, que están compuestas por monómeros de aminoácidos unidos por enlaces peptídicos, y moléculas de ADN, que están compuestas por nucleótidos unidos por enlaces fosfodiéster.
Propiedades de las reacciones químicas
[editar]La biosíntesis se produce debido a una serie de reacciones químicas. Para que estas reacciones tengan lugar, son necesarios los siguientes elementos:[1]
- Compuestos precursores: estos compuestos son las moléculas o sustratos de partida en una reacción. Estos también pueden ser vistos como los reactivos en un proceso químico dado.
- Energía química: la energía química se puede encontrar en forma de moléculas de alta energía. Estas moléculas son necesarias para reacciones desfavorables energéticamente. Además, la hidrólisis de estos compuestos impulsa una reacción hacia adelante. Las moléculas de alta energía, como el ATP, tienen tres fosfatos. A menudo, el fosfato terminal se separa durante la hidrólisis y se transfiere a otra molécula.
- Enzimas catalíticas: estas moléculas son proteínas especiales que catalizan una reacción al aumentar la velocidad de la reacción y disminuir la energía de activación.
- Coenzimas o cofactores: los cofactores son moléculas que ayudan en las reacciones químicas. Estos pueden ser iones metálicos, derivados vitamínicos como NADH y acetil CoA, o derivados no vitamínicos como ATP. En el caso de NADH, la molécula transfiere un hidrógeno, mientras que la acetil CoA transfiere un grupo acetilo, y el ATP transfiere un fosfato.
En el sentido más simple, las reacciones que ocurren en la biosíntesis tienen el siguiente formato:[2]
Algunas variaciones de esta ecuación básica que se discutirán más adelante con más detalle son:[3]
- Compuestos simples que se convierten en otros compuestos, generalmente como parte de una vía de reacción de pasos múltiples. Dos ejemplos de este tipo de reacción ocurren durante la formación de ácidos nucleicos y la carga de ARNt antes de la traducción. Para algunos de estos pasos, se requiere energía química:
- Compuestos simples que se convierten en otros compuestos con la ayuda de cofactores. Por ejemplo, la síntesis de fosfolípidos requiere acetil CoA, mientras que la síntesis de otro componente de la membrana, los esfingolípidos, requiere NADH y FADH para la formación del esqueleto de la esfingosina. La ecuación general para estos ejemplos es:
- Compuestos simples que se unen para crear una macromolécula. Por ejemplo, los ácidos grasos se unen para formar fosfolípidos. A su vez, los fosfolípidos y el colesterol interactúan de manera no covalente para formar la bicapa lipídica. Esta reacción se puede describir de la siguiente manera:
Lípidos
[editar]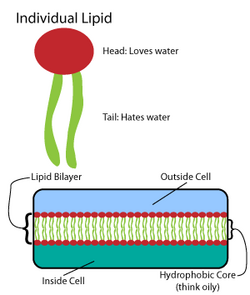
Muchas macromoléculas intrincadas se sintetizan en un patrón de estructuras simples y repetidas.[4] Por ejemplo, las estructuras más simples de los lípidos son los ácidos grasos. Los ácidos grasos son derivados de hidrocarburos ; contienen una "cabeza" de grupo carboxilo y una "cola" de cadena de hidrocarburo.[4] Estos ácidos grasos crean componentes más grandes que, a su vez incorporan interacciones no covalentes para formar la bicapa lipídica.[4] Las cadenas de ácidos grasos se encuentran en dos componentes principales de los lípidos de membrana: los fosfolípidos y los esfingolípidos. Un tercer componente principal de la membrana, el colesterol, no contiene estas unidades de ácidos grasos.[5]
Fosfolípidos
[editar]La base de todas las biomembranas consiste en una estructura bicapa de fosfolípidos.[6] La molécula de fosfolípido es anfipática; contiene una cabeza polar hidrofílica y una cola no polar hidrofóbica.[4] Las cabezas de fosfolípidos interactúan entre sí y con los medios acuosos, mientras que las colas de hidrocarburos se orientan en el centro, lejos del agua.[7] Estas últimas interacciones impulsan la estructura de dos capas que actúa como una barrera para los iones y las moléculas.[8]
Hay varios tipos de fosfolípidos; en consecuencia, sus vías de síntesis difieren. Sin embargo, el primer paso en la síntesis de fosfolípidos implica la formación de fosfatidato o diacilglicerol 3-fosfato en el retículo endoplásmico y la membrana mitocondrial externa.[7] La ruta de síntesis se encuentra a continuación:

La ruta comienza con glicerol 3-fosfato, que se convierte en lisofosfatidato a través de la adición de una cadena de ácido graso proporcionada por la acil coenzima A.[9] Luego, el lisofosfatidato se convierte en fosfatidato a través de la adición de otra cadena de ácido graso contribuida por un segundo acil CoA; Todos estos pasos son catalizados por la enzima glicerol fosfato aciltransferasa.[9] La síntesis de fosfolípidos continúa en el retículo endoplásmico, y la vía de biosíntesis difiere dependiendo de los componentes del fosfolípido particular.[9]
Esfingolípidos
[editar]Al igual que los fosfolípidos, estos derivados de ácidos grasos tienen una cabeza polar y colas no polares.[5] A diferencia de los fosfolípidos, los esfingolípidos tienen un esqueleto de esfingosina.[10] Los esfingolípidos existen en las células eucariotas y son particularmente abundantes en el sistema nervioso central.[7] Por ejemplo, la esfingomielina es parte de la vaina de mielina de las fibras nerviosas.[11]
Los esfingolípidos se forman a partir de ceramidas que consisten en una cadena de ácido graso unida al grupo amino de un esqueleto de esfingosina. Estas ceramidas se sintetizan a partir de la acilación de la esfingosina.[11] La vía biosintética para la esfingosina se encuentra a continuación:

Como indica la imagen, durante la síntesis de la esfingosina, el palmitoil CoA y la serina experimentan una reacción de condensación que da como resultado la formación de deshidrosfingosina.[7] Este producto se reduce luego para formar dihidrospingosina, que se convierte en esfingosina a través de la reacción de oxidación mediante FAD.[7]
Colesterol
[editar]Este lípido pertenece a una clase de moléculas llamadas esteroles.[5] Los esteroles tienen cuatro anillos fusionados y un grupo hidroxilo.[5] El colesterol es una molécula particularmente importante. No solo sirve como un componente de las membranas lipídicas, sino que también es un precursor de varias hormonas esteroides, como el cortisol, la testosterona y el estrógeno.[12]
El colesterol se sintetiza a partir de acetil CoA.[12] El camino se muestra a continuación:

De manera más general, esta síntesis ocurre en tres etapas, la primera etapa tiene lugar en el citoplasma y la segunda y tercera etapas se producen en el retículo endoplásmico.[9] Las etapas son las siguientes:[12]
- La síntesis de pirofosfato de isopentenilo, el "bloque de construcción" del colesterol
- La formación de escualeno a través de la condensación de seis moléculas de fosfato de isopentenilo.
- La conversión de escualeno en colesterol a través de varias reacciones enzimáticas.
Nucleótidos
[editar]La biosíntesis de nucleótidos implica reacciones catalizadas por enzimas que convierten los sustratos en productos más complejos.[1] Los nucleótidos son los componentes básicos del ADN y el ARN. Los nucleótidos están compuestos por un anillo de cinco miembros formado por azúcar de ribosa en el ARN y azúcar de desoxirribosa en el ADN; estos azúcares están vinculados a una base de purina o pirimidina con un enlace glucosídico y un grupo fosfato en la ubicación 5 ' del azúcar.[13]
Nucleótidos de purina
[editar]
Los nucleótidos de ADN adenosina y guanosina consisten en una base de purina unida a un azúcar ribosa con un enlace glicosídico. En el caso de los nucleótidos de ARN desoxiadenosina y desoxiguanosina, las bases de purina se unen a un azúcar de desoxirribosa con un enlace glicosídico. Las bases de purina en los nucleótidos de ADN y ARN se sintetizan en un mecanismo de reacción de doce pasos presente en la mayoría de los organismos unicelulares. Los eucariotas superiores emplean un mecanismo de reacción similar en diez pasos de reacción. Las bases de purina se sintetizan convirtiendo el pirofosfato de fosforibosilo (PRPP) en monofosfato de inosina (IMP), que es el primer intermediario clave en la biosíntesis de la base de purina.[14] La modificación enzimática adicional de IMP produce las bases de adenosina y guanosina de nucleótidos.
- El primer paso en la biosíntesis de purinas es una reacción de condensación, realizada por la glutamina-PRPP amidotransferasa. Esta enzima transfiere el grupo amino de la glutamina a la PRPP, formando 5-fosforibosilamina. El siguiente paso requiere la activación de la glicina mediante la adición de un grupo fosfato de ATP.
- GAR sintetasa[15] realiza la condensación de glicina activada en PRPP, formando ribonucleótido de glicinamida (GAR).
- GAR transformilasa agrega un grupo formilo al grupo amino de GAR, formando ribonucleótido formilglicinamida (FGAR).
- La amidotransferasa[16] FGAR cataliza la adición de un grupo de nitrógeno a FGAR, formando ribonucleótido formilglicinamidina (FGAM).
- La FGAM ciclasa cataliza el cierre del anillo, lo que implica la eliminación de una molécula de agua, formando el anillo de imidazol de 5 miembros 5-aminoimidazol ribonucleótido (AIR).
- La N5-CAIR sintetasa transfiere un grupo carboxilo, formando el intermedio N5-carboxiaminoimidazol ribonucleótido (N5-CAIR).[17]
- La mutasa N5-CAIR reorganiza el grupo funcional carboxilo y lo transfiere al anillo de imidazol, formando ribonucleótido carboxiaminoimidazol (CAIR). El mecanismo de dos pasos de la formación de CAIR a partir del AIRE se encuentra principalmente en organismos unicelulares. Los eucariotas superiores contienen la enzima AIR carboxilasa,[18] que transfiere un grupo carboxilo directamente al anillo de imidazol de AIR, formando CAIR.
- La sintetasa de SAICAR forma un enlace peptídico entre el aspartato y el grupo carboxilo agregado del anillo imidazol, formando N-succinil-5-aminoimidazol-4-carboxamida ribonucleótido (SAICAR).
- SAICAR liasa elimina el esqueleto de carbono del aspartato agregado, dejando el grupo amino y formando ribonucleótido 5-aminoimidazol-4-carboxamida (AICAR).
- AICAR transformilasa transfiere un grupo carbonilo a AICAR, formando N-formilaminoimidazol-4-carboxamida ribonucleótido (FAICAR).
- El último paso consiste en la enzima IMP sintasa, que realiza el cierre del anillo de purina y forma el intermedio monofosfato de inosina.[5]
Nucleótidos de pirimidina
[editar]
Otras bases de nucleótidos de ADN y ARN que están vinculadas al azúcar de la ribosa a través de un enlace glicosídico son la timina, la citosina y el uracilo (que solo se encuentra en el ARN). La biosíntesis de monofosfato de uridina implica una enzima que se encuentra en la membrana interna mitocondrial y enzimas multifuncionales que se encuentran en el citosol.[19]
- El primer paso implica la enzima fosfato sintasa carbamoil la combinación de glutamina con CO2 en una reacción dependiente de ATP para formar fosfato de carbamoílo.
- La aspartato carbamoiltransferasa condensa el carbamoilfosfato con el aspartato para formar uridosuccinato.
- La dihidroorotasa realiza el cierre del anillo, una reacción que pierde agua, para formar dihidroorotato.
- La dihidroorotato deshidrogenasa, ubicada dentro de la membrana interna mitocondrial,[19] oxida el dihidroorotato a orotato.
- La orotato fosforribosil hidrolasa (OMP pirofosforilasa) condensa el orotato con PRPP para formar orotidina-5'-fosfato.
- La descarboxilasa OMP cataliza la conversión de orotidina-5'-fosfato en UMP.[20]
Después de que se sintetiza la base de nucleótidos de uridina, se sintetizan las otras bases, la citosina y la timina. La biosíntesis de la citosina es una reacción de dos pasos que implica la conversión de UMP a UTP. La adición de fosfato a UMP es catalizada por una enzima quinasa. La enzima CTP sintasa cataliza la siguiente etapa de reacción: la conversión de UTP en CTP mediante la transferencia de un grupo amino de glutamina a uridina; Esto forma la base de citosina de CTP.[21] El mecanismo, que describe la reacción UTP + ATP + glutamina ⇔ CTP + ADP + glutamato, se encuentra a continuación:


La citosina es un nucleótido que está presente tanto en el ADN como en el ARN. Sin embargo, el uracilo solo se encuentra en el ARN. Por lo tanto, después de que se sintetiza UTP, se debe convertir en una forma desoxi para incorporarse en el ADN. Esta conversión implica la enzima ribonucleósido trifosfato reductasa. Esta reacción que elimina el 2'-OH del azúcar ribosa para generar desoxirribosa no se ve afectada por las bases unidas al azúcar. Esta no especificidad permite que la ribonucleósido trifosfato reductasa convierta todos los nucleósidos trifosfatos a desoxirribonucleótido mediante un mecanismo similar.[21]
En contraste con el uracilo, las bases de timina se encuentran principalmente en el ADN, no en el ARN. Las células normalmente no contienen bases de timina que están vinculadas a los azúcares de la ribosa en el ARN, lo que indica que las células solo sintetizan la timina unida a la desoxirribosa. La enzima timidilato sintetasa es responsable de sintetizar los residuos de timina de dUMP a dTMP. Esta reacción transfiere un grupo metilo a la base de uracilo de dUMP para generar dTMP.[21] La reacción de la timidilato sintasa, dUMP + 5,10-metilentetrahidrofolato ⇔ dTMP + dihidrofolato, se muestra a la derecha.
ADN
[editar]
Aunque hay diferencias entre la síntesis de ADN eucarióticos y procarióticos, la siguiente sección denota las características clave de la replicación del ADN compartida por ambos organismos.
El ADN está compuesto de nucleótidos que están unidos por enlaces fosfodiéster.[4] La síntesis de ADN, que tiene lugar en el núcleo, es un proceso semiconservador, lo que significa que la molécula de ADN resultante contiene una cadena original de la estructura principal y una nueva cadena.[22] La síntesis de ADN es catalizada por una familia de ADN polimerasas que requieren cuatro trifosfatos de desoxinucleósidos, una cadena de plantilla y un cebador con un 3'OH libre en el que se incorporan nucleótidos.[23]
Para que se produzca la replicación del ADN, se crea una horquilla de replicación mediante enzimas llamadas helicasas que desenrollan la hélice del ADN.[23] Las topoisomerasas en la horquilla de replicación eliminan los supercoils causados por el desenrollado del ADN, y las proteínas de unión al ADN de una sola hebra mantienen las dos plantillas de ADN de una sola hebra estabilizadas antes de la replicación.[13]
La síntesis de ADN se inicia con la ARN polimerasa primasa, que produce un cebador de ARN con un 3'OH libre.[23] Este cebador está unido a la plantilla de ADN de cadena sencilla, y la ADN polimerasa alarga la cadena incorporando nucleótidos; la ADN polimerasa también corrige la nueva cadena de ADN sintetizada.[23]
Durante la reacción de polimerización catalizada por la ADN polimerasa, se produce un ataque nucleofílico por el 3'OH de la cadena en crecimiento en el átomo de fósforo más interno de un trifosfato de deoxinucleósido; esto produce la formación de un puente de fosfodiéster que une un nuevo nucleótido y libera pirofosfato.[9]
Dos tipos de cadenas se crean simultáneamente durante la replicación: la cadena principal, que se sintetiza continuamente y crece hacia la bifurcación de replicación, y la cadena retrasada, que se realiza de forma discontinua en los fragmentos de Okazaki y se aleja de la bifurcación de replicación.[22] Los fragmentos de Okazaki se unen covalentemente por la ADN ligasa para formar una cadena continua.[22] Luego, para completar la replicación del ADN, se eliminan los cebadores de ARN, y las brechas resultantes se reemplazan con el ADN y se unen a través de la ADN ligasa.[22]
Aminoácidos
[editar]Una proteína es un polímero que se compone de aminoácidos que están unidos por enlaces peptídicos. Hay más de 300 aminoácidos encontrados en la naturaleza de los cuales solo veinte, conocidos como los aminoácidos estándar, son los componentes básicos de la proteína.[24] Solo las plantas verdes y la mayoría de los microbios son capaces de sintetizar todos los 20 aminoácidos estándar que son necesarios para todas las especies vivas. Los mamíferos solo pueden sintetizar diez de los veinte aminoácidos estándar. Los otros aminoácidos, valina, metionina, leucina, isoleucina, fenilalanina, lisina, treonina y triptófano para adultos e histidina, y arginina para bebés se obtienen a través de la dieta.[25]
Estructura básica del aminoácido
[editar]
La estructura general de los aminoácidos estándar incluye un grupo amino primario, un grupo carboxilo y el grupo funcional unido al carbono α. Los diferentes aminoácidos se identifican por el grupo funcional. Como resultado de los tres grupos diferentes unidos al carbono α, los aminoácidos son moléculas asimétricas. Para todos los aminoácidos estándar, excepto la glicina, el carbono α es un centro quiral. En el caso de la glicina, el carbono α tiene dos átomos de hidrógeno, lo que agrega simetría a esta molécula. Con la excepción de la prolina, todos los aminoácidos encontrados en la vida tienen la conformación L-isoforma. La prolina tiene un grupo funcional en el carbono α que forma un anillo con el grupo amino.[24]

Fuentes de nitrógeno
[editar]Un paso importante en la biosíntesis de aminoácidos consiste en incorporar un grupo de nitrógeno en el carbono α. En las células, hay dos vías principales para incorporar grupos de nitrógeno. Una vía involucra la enzima glutamina oxoglutarato aminotransferasa (GOGAT) que elimina el grupo amino amida de la glutamina y la transfiere a 2-oxoglutarato, produciendo dos moléculas de glutamato. En esta reacción de catálisis, la glutamina sirve como fuente de nitrógeno. Una imagen que ilustra esta reacción se encuentra a la derecha.
La otra vía para incorporar nitrógeno en el carbono α de los aminoácidos es la enzima glutamato deshidrogenasa (GDH). GDH puede transferir amoníaco a 2-oxoglutarato y formar glutamato. Además, la enzima glutamina sintetasa (GS) es capaz de transferir amoníaco a glutamato y sintetizar glutamina, que repone glutamina.[26]
La familia del glutamato de aminoácidos
[editar]La familia de aminoácidos del glutamato incluye los aminoácidos que se derivan del aminoácido glutamato. Esta familia incluye: glutamato, glutamina, prolina y arginina. Esta familia también incluye el aminoácido lisina, que se deriva de α-cetoglutarato.[27]
La biosíntesis del glutamato y la glutamina es un paso clave en la asimilación del nitrógeno discutido anteriormente. Las enzimas GOGAT y GDH catalizan las reacciones de asimilación del nitrógeno.
En las bacterias, la enzima glutamato 5-quinasa inicia la biosíntesis de la prolina al transferir un grupo fosfato de ATP a glutamato. La siguiente reacción es catalizada por la enzima pirrolina-5-carboxilato sintasa (P5CS), que cataliza la reducción del grupo ϒ-carboxilo de L-glutamato 5-fosfato. Esto resulta en la formación de glutamato semialdehído, que cicla espontáneamente a pirrolina-5-carboxilato. La pirrolina-5-carboxilato se reduce adicionalmente por la enzima pirrolina-5-carboxilato reductasa (P5CR) para producir un aminoácido prolina.[28]
En el primer paso de la biosíntesis de arginina en bacterias, el glutamato se acetila transfiriendo el grupo acetilo de acetil-CoA a la posición N-α; Esto evita la ciclación espontánea. La enzima N-acetilglutamato sintasa (glutamato N-acetiltransferasa) es responsable de catalizar la etapa de acetilación. Los pasos subsiguientes son catalizados por las enzimas N-acetilglutamato quinasa, N-acetil-gamma-glutamil-fosfato reductasa y acetilornitina / succinildiamino pimelato aminotransferasa y producen la N-acetil-L-ornitina. El grupo acetilo de la acetilornitina se elimina con la enzima acetilornitinasa (AO) o la ornitina acetiltransferasa (OAT), y esto produce la ornitina. Luego, las enzimas citrulina y argininosuccinato convierten la ornitina en arginina.[29]

Existen dos vías distintas de biosíntesis de lisina: la vía del ácido diaminopimélico y la vía del α-aminoadipato. La más común de las dos vías sintéticas es la vía del ácido diaminopimélico; consiste en varias reacciones enzimáticas que agregan grupos de carbono al aspartato para producir lisina:[30]
- La aspartato quinasa inicia la ruta del ácido diaminopimélico mediante la fosforilación del aspartato y la producción de fosfato de aspartilo.
- Aspartate semialdehído deshidrogenasa cataliza la reducción dependiente de NADPH del fosfato de aspartilo para producir aspartato semialdehído.
- La 4-hidroxi-tetrahidrodipicolinato sintasa agrega un grupo piruvato al β-aspartil-4-semialdehído, y se elimina una molécula de agua. Esto provoca la ciclación y da lugar a (2S, 4S) -4-hidroxi-2,3,4,5-tetrahidrodipicolinato.
- La 4-hidroxi-tetrahidrodipicolinato reductasa cataliza la reducción de (2S, 4S) -4-hidroxi-2,3,4,5-tetrahidrodipicolinato por NADPH para producir Δ'-piperidina-2,6-dicarboxilato (2,3,4, 5-tetrahidrodipicolinato) y H2O.
- La tetrahidrodipicolinato aciltransferasa cataliza la reacción de acetilación que produce la apertura del anillo y produce N-acetil α-amino-ε-cetopimelato.
- La N-succinil-α-amino-ε-cetopimelato-glutamato aminotransaminasa cataliza la reacción de transaminación que elimina el grupo ceto de N-acetil α-amino-ε-cetopimelato y la reemplaza por un grupo amino para producir N-succinil-L-diaminopimelato.[31]
- La N-acildiaminopimelato ciclasa cataliza la desacilación de N-succinil-L-diaminopimelato para producir L, L-diaminopimelato.[32]
- La epimerasa DAP cataliza la conversión de L, L-diaminopimelato a la forma meso de L, L-diaminopimelato.[33]
- La descarboxilasa DAP cataliza la eliminación del grupo carboxilo, produciendo L-lisina.
La familia serina de los aminoácidos
[editar]La serina familia de aminoácidos incluye: serina, cisteína, y glicina. La mayoría de los microorganismos y plantas obtienen el azufre para sintetizar la metionina a partir del aminoácido cisteína. Además, la conversión de serina en glicina proporciona los carbonos necesarios para la biosíntesis de la metionina y la histidina.[27]
Durante la biosíntesis de serina,[34] la enzima fosfoglicerato deshidrogenasa cataliza la reacción inicial que oxida el 3-fosfo-D-glicerato para producir 3-fosfonooxipiruvato.[35] La siguiente reacción es catalizada por la enzima fosfoserina aminotransferasa, que transfiere un grupo amino del glutamato a 3-fosfonooxipiruvato para producir L-fosfoserina.[36] El paso final es catalizado por la enzima fosfoserina fosfatasa, que desfosforila L-fosfoserina para producir L-serina.[37]
Hay dos vías conocidas para la biosíntesis de glicina. Los organismos que utilizan etanol y acetato como la principal fuente de carbono utilizan la vía gliconeogénica para sintetizar glicina. La otra vía de la biosíntesis de glicina se conoce como la vía glicolítica. Esta vía convierte la serina sintetizada a partir de los intermedios de la glucólisis en glicina. En la vía glucolítica, la enzima serina hidroximetiltransferasa cataliza la escisión de la serina para producir glicina y transfiere el grupo de carbono escindido de la serina a tetrahidrofolato, formando 5,10-metileno-tetrahidrofolato.[38]
La biosíntesis de la cisteína es una reacción de dos pasos que implica la incorporación de azufre inorgánico. En microorganismos y plantas, la enzima serina acetiltransferasa cataliza la transferencia del grupo acetilo de acetil-CoA a L-serina para producir O-acetil-L-serina.[39] La siguiente etapa de reacción, catalizada por la enzima O-acetil serina (tiol) liasa, reemplaza el grupo acetilo de O-acetil-L-serina con sulfuro para producir cisteína.[40]
La familia de aminoácidos del aspartato
[editar]La familia de aminoácidos de aspartato incluye: treonina, lisina, metionina, isoleucina y aspartato. La lisina y la isoleucina se consideran parte de la familia del aspartato, aunque parte de su estructura carbonada se deriva del piruvato. En el caso de la metionina, el carbono metílico se deriva de la serina y el grupo de azufre, pero en la mayoría de los organismos, se deriva de la cisteína.[27]
La biosíntesis del aspartato es una reacción en un solo paso que es catalizada por una sola enzima. La enzima aspartato aminotransferasa cataliza la transferencia de un grupo amino de aspartato a α-cetoglutarato para producir glutamato y oxaloacetato.[41] La asparagina se sintetiza mediante una adición dependiente de ATP de un grupo amino en el aspartato; la asparagina sintetasa cataliza la adición de nitrógeno de la glutamina o amoníaco soluble al aspartato para producir asparagina.[42]

La vía biosintética del ácido diaminopimélico de la lisina pertenece a la familia de aminoácidos del aspartato. Esta vía involucra nueve reacciones catalizadas por enzimas que convierten el aspartato en lisina.[43]
- La aspartato quinasa cataliza el paso inicial en la ruta del ácido diaminopimélico transfiriendo un fosforilo de ATP al grupo carboxilato de aspartato, que produce aspartil-β-fosfato.[44]
- Aspartato-semialdehído deshidrogenasa cataliza la reacción de reducción por desfosforilación de aspartil-β-fosfato para producir aspartato-β-semialdehído.[45]
- La dihidrodipicolinato sintasa cataliza la reacción de condensación de aspartato-β-semialdehído con piruvato para producir ácido dihidrodipicolínico.[46]
- La 4-hidroxi-tetrahidrodipicolinato reductasa cataliza la reducción del ácido dihidrodipicolínico para producir ácido tetrahidrodipicolínico.[47]
- La tetrahidrodipicolinato N-succiniltransferasa cataliza la transferencia de un grupo succinilo de succinil-CoA a ácido tetrahidrodipicolínico para producir N-succinil-L-2,6-diaminoheptanodioato.[48]
- La N-succinildiaminopimelato aminotransferasa cataliza la transferencia de un grupo amino del glutamato a N-succinil-L-2,6-diaminoheptanodioato para producir ácido N-succinil-L, L-diaminopimélico.[49]
- La succinil-diaminopimelato desuccinilasa cataliza la eliminación del grupo acilo del ácido N-succinil-L, L-diaminopimélico para producir ácido L, L-diaminopimélico.[50]
- Diaminopimelate epimerasa cataliza la inversión del carbono α de ácido L, L-diaminopimélico para producir ácido meso-diaminopimélico.[51]
- La descarboxilasa de siaminopimela cataliza el paso final en la biosíntesis de la lisina que elimina el grupo de dióxido de carbono del ácido meso-diaminopimélico para producir L-lisina.[52]
Proteínas
[editar]

La síntesis de proteínas se produce a través de un proceso llamado traducción.[53] Durante la traducción, los ribosomas leen el material genético llamado ARNm para generar una cadena polipeptídica de proteínas.[53] Este proceso requiere la transferencia de ARN (ARNt) que sirve como adaptador al unir los aminoácidos en un extremo e interactuar con el ARNm en el otro extremo; el último emparejamiento entre el ARNt y el ARNm asegura que se agregue el aminoácido correcto a la cadena.[53] La síntesis de proteínas se produce en tres fases: iniciación, elongación y terminación.[13] La traducción procariótica se diferencia de la traducción eucariota; sin embargo, esta sección se centrará principalmente en los puntos en común entre los dos organismos.
Fondo adicional
[editar]Antes de que pueda comenzar la traducción, debe ocurrir el proceso de unión de un aminoácido específico a su ARNt correspondiente. Esta reacción, llamada carga de ARNt, es catalizada por la aminoacil ARNt sintetasa.[54] Una tRNA sintetasa específica es responsable de reconocer y cargar un aminoácido en particular.[54] Además, esta enzima tiene regiones discriminadoras especiales para garantizar la correcta unión entre el ARNt y su aminoácido relacionado.[54] El primer paso para unir un aminoácido a su ARNt correspondiente es la formación de aminoacil-AMP:[54]
A esto le sigue la transferencia del grupo aminoacilo de aminoacil-AMP a una molécula de ARNt. La molécula resultante es aminoacil-ARNt:[54]
La combinación de estos dos pasos, ambos catalizados por la aminoacil ARNt sintetasa, produce un ARNt cargado que está listo para agregar aminoácidos a la cadena polipeptídica en crecimiento.
Además de unirse a un aminoácido, el ARNt tiene una unidad de tres nucleótidos llamada anticodón que se empareja con tripletes de nucleótidos específicos en el ARNm llamado codones; los codones codifican un aminoácido específico.[55] Esta interacción es posible gracias al ribosoma, que sirve como sitio para la síntesis de proteínas. El ribosoma posee tres sitios de unión a ARNt: el sitio aminoacilo (sitio A), el sitio peptidilo (sitio P) y el sitio de salida (sitio E).[56]
Hay numerosos codones dentro de un transcrito de ARNm, y es muy común que un aminoácido sea especificado por más de un codón; este fenómeno se llama degeneración.[57] En total, hay 64 codones, 61 de cada código para uno de los 20 aminoácidos, mientras que los codones restantes especifican la terminación de la cadena.[57]
Traducción en pasos
[editar]Como se mencionó anteriormente, la traducción ocurre en tres fases: iniciación, elongación y terminación.

Paso 1: Iniciación
[editar]La finalización de la fase de iniciación depende de los siguientes tres eventos:[13]
1. El reclutamiento del ribosoma a mRNA
2. La unión de un ARNt iniciador cargado en el sitio P del ribosoma
3. La alineación correcta del ribosoma con el codón de inicio del ARNm
Paso 2: Alargamiento
[editar]Tras el inicio, la cadena polipeptídica se extiende a través de las interacciones anticodón: codón, y el ribosoma agrega aminoácidos a la cadena polipeptídica uno por uno. Deben darse los siguientes pasos para garantizar la correcta adición de aminoácidos:[58]
1. La unión del ARNt correcto en el sitio A del ribosoma
2. La formación de un enlace peptídico entre el ARNt en el sitio A y la cadena polipeptídica unida al ARNt en el sitio P
3. Translocación o avance del complejo ARNt-ARNm por tres nucleótidos
La translocación "inicia" el ARNt en el sitio E y cambia el ARNt desde el sitio A al sitio P, dejando el sitio A libre para que un ARNt entrante agregue otro aminoácido.
Paso 3: Terminación
[editar]La última etapa de la traducción ocurre cuando un codón de parada ingresa al sitio A.[1] Luego, se producen los siguientes pasos:
1. El reconocimiento de los codones por los factores de liberación, que causa la hidrólisis de la cadena polipeptídica del ARNt ubicado en el sitio P[1]
2. La liberación de la cadena polipeptídica[57]
3. La disociación y el "reciclaje" del ribosoma para futuros procesos de traducción[57]
Una tabla de resumen de los jugadores clave en la traducción se encuentra a continuación:
| Participantes clave en la traducción | Etapa de traducción | Propósito |
|---|---|---|
| tRNA sintetasa | antes de la iniciación | Responsable de la carga de ARNt |
| ARNm | Iniciación, alargamiento, terminación. | Plantilla para síntesis de proteínas; Contiene regiones llamadas codones que codifican aminoácidos |
| ARNt | Iniciación, alargamiento, terminación. | Se une a los sitios ribosomas A, P, E; pares de bases anticodón con el codón de ARNm para garantizar que el aminoácido correcto se incorpore a la cadena polipeptídica en crecimiento |
| ribosoma | Iniciación, alargamiento, terminación. | Dirige la síntesis de proteínas y cataliza la formación del enlace peptídico. |
Enfermedades asociadas a deficiencia de macromoléculas
[editar]
Los errores en las rutas biosintéticas pueden tener consecuencias perjudiciales, como la malformación de las macromoléculas o la producción insuficiente de moléculas funcionales. A continuación hay ejemplos que ilustran las interrupciones que ocurren debido a estas ineficiencias.
- Hipercolesterolemia familiar: este trastorno se caracteriza por la ausencia de receptores funcionales para las LDL.[59] Las deficiencias en la formación de receptores de LDL pueden causar receptores defectuosos que interrumpen la vía endocítica, inhibiendo la entrada de LDL en el hígado y otras células.[59] Esto causa una acumulación de LDL en el plasma sanguíneo, lo que resulta en placas ateroscleróticas que estrechan las arterias y aumentan el riesgo de ataques cardíacos.[59]
- Síndrome de Lesch-Nyhan: esta enfermedad genética se caracteriza por la automutilación, la deficiencia mental y la gota.[60] Es causada por la ausencia de hipoxantina-guanina fosforribosiltransferasa, que es una enzima necesaria para la formación de nucleótidos de purina.[60] La falta de enzima reduce el nivel de nucleótidos necesarios y provoca la acumulación de intermedios de biosíntesis, lo que resulta en el comportamiento inusual mencionado anteriormente.[60]
- Inmunodeficiencia combinada grave (SCID): la SCID se caracteriza por una pérdida de células T.[61] La escasez de estos componentes del sistema inmunológico aumenta la susceptibilidad a los agentes infecciosos porque los individuos afectados no pueden desarrollar memoria inmunológica.[61] Este trastorno inmunológico es el resultado de una deficiencia en la actividad de la adenosina deanimasa, que causa una acumulación de dATP. Estas moléculas dATP luego inhiben la ribonucleótido reductasa, lo que impide la síntesis de ADN.[61]
- Enfermedad de Huntington: esta enfermedad neurológica es causada por errores que ocurren durante la síntesis de ADN.[62] Estos errores o mutaciones conducen a la expresión de una proteína de huntingtina mutante, que contiene residuos de glutamina repetitivos que se codifican al expandir las repeticiones de trinucleótidos CAG en el gen.[62] La enfermedad de Huntington se caracteriza por pérdida neuronal y gliosis. Los síntomas de la enfermedad incluyen: trastorno del movimiento, deterioro cognitivo y trastorno del comportamiento.[63]
Véase también
[editar]- Lípidos
- Bicapa de fosfolípidos
- Nucleótidos
- ADN
- Replicación de ADN
- Aminoácido Proteogénico
- Tabla de codones
- Prostaglandina
Referencias
[editar]- ↑ a b c d Alberts, Bruce (2007). Molecular biology of the cell. New York: Garland Science. ISBN 978-0815341055.
- ↑ Zumdahl, Steven S. Zumdahl, Susan A. (2008). Chemistry (8th edición). CA: Cengage Learning. ISBN 978-0547125329.
- ↑ Pratt, Donald Voet, Judith G. Voet, Charlotte W. (2013). Fundamentals of biochemistry : life at the molecular level (4th edición). Hoboken, NJ: Wiley. ISBN 978-0470547847.
- ↑ a b c d e Lodish, Harvey (2007). Molecular cell biology (6th edición). New York: W.H. Freeman. ISBN 978-0716743668.
- ↑ a b c d e Cox, David L. Nelson, Michael M. (2008). Lehninger principles of biochemistry (5th edición). New York: W.H. Freeman. ISBN 9780716771081.
- ↑ Hanin, Israel (2013). Phospholipids: Biochemical, Pharmaceutical, and Analytical Considerations. Springer. ISBN 978-1475713664.
- ↑ a b c d e Vance, Dennis E.; Vance, Jean E. (2008). Biochemistry of lipids, lipoproteins and membranes (5th edición). Amsterdam: Elsevier. ISBN 978-0444532190.
- ↑ Katsaras, J. (2001). Lipid bilayers : structure and interactions ; with 6 tables. Berlin [u.a.]: Springer. ISBN 978-3540675556.
- ↑ a b c d e Stryer, Jeremy M. Berg; John L. Tymoczko; Lubert (2007). Biochemistry (6. ed., 3. print. edición). New York: Freeman. ISBN 978-0716787242.
- ↑ Gault, CR; LM Obeid; YA Hannun (2010). An Overview of sphingolipid metabolism: from synthesis to breakdown 688. pp. 1-23. ISBN 978-1-4419-6740-4. doi:10.1007/978-1-4419-6741-1_1.
- ↑ a b Siegel, George J. (1999). Basic neurochemistry : molecular, cellular and medical aspects (6. edición). Philadelphia, Pa. [u.a.]: Lippincott Williams & Wilkins. ISBN 978-0397518203.
- ↑ a b c Harris, J. Robin (2010). Cholesterol binding and cholesterol transport proteins : structure and function in health and disease. Dordrecht: Springer. ISBN 978-9048186211.
- ↑ a b c d Watson, James D. (2007). Molecular biology of the gene (6th edición). San Francisco, Calif.: Benjamin Cummings. ISBN 978-0805395921.
- ↑ Kappock, TJ; Ealick, SE; Stubbe, J (October 2000). «Modular evolution of the purine biosynthetic pathway.». Current Opinion in Chemical Biology 4 (5): 567-72. PMID 11006546. doi:10.1016/s1367-5931(00)00133-2.
- ↑ Sampei, G; Baba, S; Kanagawa, M; Yanai, H; Ishii, T; Kawai, H; Fukai, Y; Ebihara, A et al. (October 2010). «Crystal structures of glycinamide ribonucleotide synthetase, PurD, from thermophilic eubacteria.». Journal of Biochemistry 148 (4): 429-38. PMID 20716513. doi:10.1093/jb/mvq088.
- ↑ Hoskins, AA; Anand, R; Ealick, SE; Stubbe, J (Aug 17, 2004). «The formylglycinamide ribonucleotide amidotransferase complex from Bacillus subtilis: metabolite-mediated complex formation.». Biochemistry 43 (32): 10314-27. PMID 15301530. doi:10.1021/bi049127h.
- ↑ Mueller, EJ; Meyer, E; Rudolph, J; Davisson, VJ; Stubbe, J (1 de marzo de 1994). «N5-carboxyaminoimidazole ribonucleotide: evidence for a new intermediate and two new enzymatic activities in the de novo purine biosynthetic pathway of Escherichia coli.». Biochemistry 33 (8): 2269-78. PMID 8117684. doi:10.1021/bi00174a038.
- ↑ Firestine, SM; Poon, SW; Mueller, EJ; Stubbe, J; Davisson, VJ (4 de octubre de 1994). «Reactions catalyzed by 5-aminoimidazole ribonucleotide carboxylases from Escherichia coli and Gallus gallus: a case for divergent catalytic mechanisms.». Biochemistry 33 (39): 11927-34. PMID 7918411. doi:10.1021/bi00205a031.
- ↑ a b Srere, PA (1987). «Complexes of sequential metabolic enzymes.». Annual Review of Biochemistry 56 (1): 89-124. PMID 2441660. doi:10.1146/annurev.bi.56.070187.000513.
- ↑ Broach, edited by Jeffrey N. Strathern, Elizabeth W. Jones, James R. (1981). The Molecular biology of the yeast Saccharomyces. Cold Spring Harbor, N.Y.: Cold Spring Harbor Laboratory. ISBN 978-0879691394.
- ↑ a b c O'Donovan, GA; Neuhard, J (September 1970). «Pyrimidine metabolism in microorganisms.». Bacteriological Reviews 34 (3): 278-343. PMC 378357. PMID 4919542.
- ↑ a b c d Geer, Gerald Karp ; responsible for the revision of chapter 15 Peter van der (2004). Cell and molecular biology : concepts and experiments (4th ed., Wiley International edición). New York: J. Wiley & Sons. ISBN 978-0471656654.
- ↑ a b c d Griffiths, Anthony J. F. (1999). Modern genetic analysis (2. print. edición). New York: Freeman. ISBN 978-0716731184.
- ↑ a b Wu, G (May 2009). «Amino acids: metabolism, functions, and nutrition.». Amino Acids 37 (1): 1-17. PMID 19301095. doi:10.1007/s00726-009-0269-0.
- ↑ Mousdale, D. M.; Coggins, J. R. (1991). Amino Acid Synthesis. pp. 29-56. ISBN 978-1-4899-2435-3. doi:10.1007/978-1-4899-2433-9_2.
- ↑ Miflin, B. J.; Lea, P. J. (1977). «Amino Acid Metabolism». Annual Review of Plant Physiology 28: 299-329. doi:10.1146/annurev.pp.28.060177.001503.
- ↑ a b c Umbarger, HE (1978). «Amino acid biosynthesis and its regulation.». Annual Review of Biochemistry 47 (1): 532-606. PMID 354503. doi:10.1146/annurev.bi.47.070178.002533.
- ↑ Pérez-Arellano, I; Carmona-Alvarez, F; Martínez, AI; Rodríguez-Díaz, J; Cervera, J (March 2010). «Pyrroline-5-carboxylate synthase and proline biosynthesis: from osmotolerance to rare metabolic disease.». Protein Science 19 (3): 372-82. PMC 2866264. PMID 20091669. doi:10.1002/pro.340.
- ↑ Xu, Y; Labedan, B; Glansdorff, N (March 2007). «Surprising arginine biosynthesis: a reappraisal of the enzymology and evolution of the pathway in microorganisms.». Microbiology and Molecular Biology Reviews 71 (1): 36-47. PMC 1847373. PMID 17347518. doi:10.1128/MMBR.00032-06.
- ↑ «MetaCyc: L-lysine biosynthesis I».
- ↑ PETERKOFSKY, B; GILVARG, C (May 1961). «N-Succinyl-L-diaminopimelic-glutamic transaminase.». The Journal of Biological Chemistry 236: 1432-8. PMID 13734750.
- ↑ KINDLER, SH; GILVARG, C (December 1960). «N-Succinyl-L-2,6-diaminopimelic acid deacylase.». The Journal of Biological Chemistry 235: 3532-5. PMID 13756049.
- ↑ Born, TL; Blanchard, JS (October 1999). «Structure/function studies on enzymes in the diaminopimelate pathway of bacterial cell wall biosynthesis.». Current Opinion in Chemical Biology 3 (5): 607-13. PMID 10508663. doi:10.1016/s1367-5931(99)00016-2.
- ↑ «Escherichia coli K-12 substr. MG1655». serine biosynthesis. SRI International. Consultado el 12 de diciembre de 2013.
- ↑ Bell, JK; Grant, GA; Banaszak, LJ (30 de marzo de 2004). «Multiconformational states in phosphoglycerate dehydrogenase.». Biochemistry 43 (12): 3450-8. PMID 15035616. doi:10.1021/bi035462e.
- ↑ Dubnovitsky, AP; Kapetaniou, EG; Papageorgiou, AC (January 2005). «Enzyme adaptation to alkaline pH: atomic resolution (1.08 A) structure of phosphoserine aminotransferase from Bacillus alcalophilus.». Protein Science 14 (1): 97-110. PMC 2253317. PMID 15608117. doi:10.1110/ps.041029805.
- ↑ Wang, W; Kim, R; Jancarik, J; Yokota, H; Kim, SH (Jan 10, 2001). «Crystal structure of phosphoserine phosphatase from Methanococcus jannaschii, a hyperthermophile, at 1.8 A resolution.». Structure 9 (1): 65-71. PMID 11342136. doi:10.1016/s0969-2126(00)00558-x.
- ↑ Monschau, N; Stahmann, KP; Sahm, H; McNeil, JB; Bognar, AL (1 de mayo de 1997). «Identification of Saccharomyces cerevisiae GLY1 as a threonine aldolase: a key enzyme in glycine biosynthesis.». FEMS Microbiology Letters 150 (1): 55-60. PMID 9163906. doi:10.1111/j.1574-6968.1997.tb10349.x.
- ↑ Pye, VE; Tingey, AP; Robson, RL; Moody, PC (24 de septiembre de 2004). «The structure and mechanism of serine acetyltransferase from Escherichia coli.». The Journal of Biological Chemistry 279 (39): 40729-36. PMID 15231846. doi:10.1074/jbc.M403751200.
- ↑ Huang, B; Vetting, MW; Roderick, SL (May 2005). «The active site of O-acetylserine sulfhydrylase is the anchor point for bienzyme complex formation with serine acetyltransferase.». Journal of Bacteriology 187 (9): 3201-5. PMC 1082839. PMID 15838047. doi:10.1128/JB.187.9.3201-3205.2005.
- ↑ McPhalen, CA; Vincent, MG; Picot, D; Jansonius, JN; Lesk, AM; Chothia, C (5 de septiembre de 1992). «Domain closure in mitochondrial aspartate aminotransferase.». Journal of Molecular Biology 227 (1): 197-213. PMID 1522585. doi:10.1016/0022-2836(92)90691-C.
- ↑ Larsen, TM; Boehlein, SK; Schuster, SM; Richards, NG; Thoden, JB; Holden, HM; Rayment, I (Dec 7, 1999). «Three-dimensional structure of Escherichia coli asparagine synthetase B: a short journey from substrate to product.». Biochemistry 38 (49): 16146-57. PMID 10587437. doi:10.1021/bi9915768.
- ↑ Velasco, AM; Leguina, JI; Lazcano, A (October 2002). «Molecular evolution of the lysine biosynthetic pathways.». Journal of Molecular Evolution 55 (4): 445-59. PMID 12355264. doi:10.1007/s00239-002-2340-2.
- ↑ Kotaka, M; Ren, J; Lockyer, M; Hawkins, AR; Stammers, DK (20 de octubre de 2006). «Structures of R- and T-state Escherichia coli aspartokinase III. Mechanisms of the allosteric transition and inhibition by lysine.». The Journal of Biological Chemistry 281 (42): 31544-52. PMID 16905770. doi:10.1074/jbc.M605886200.
- ↑ Hadfield, A; Kryger, G; Ouyang, J; Petsko, GA; Ringe, D; Viola, R (18 de junio de 1999). «Structure of aspartate-beta-semialdehyde dehydrogenase from Escherichia coli, a key enzyme in the aspartate family of amino acid biosynthesis.». Journal of Molecular Biology 289 (4): 991-1002. PMID 10369777. doi:10.1006/jmbi.1999.2828.
- ↑ Mirwaldt, C; Korndörfer, I; Huber, R (10 de febrero de 1995). «The crystal structure of dihydrodipicolinate synthase from Escherichia coli at 2.5 A resolution.». Journal of Molecular Biology 246 (1): 227-39. PMID 7853400. doi:10.1006/jmbi.1994.0078.
- ↑ Cirilli, M; Zheng, R; Scapin, G; Blanchard, JS (16 de septiembre de 2003). «The three-dimensional structures of the Mycobacterium tuberculosis dihydrodipicolinate reductase-NADH-2,6-PDC and -NADPH-2,6-PDC complexes. Structural and mutagenic analysis of relaxed nucleotide specificity.». Biochemistry 42 (36): 10644-50. PMID 12962488. doi:10.1021/bi030044v.
- ↑ Beaman, TW; Binder, DA; Blanchard, JS; Roderick, SL (Jan 21, 1997). «Three-dimensional structure of tetrahydrodipicolinate N-succinyltransferase.». Biochemistry 36 (3): 489-94. PMID 9012664. doi:10.1021/bi962522q.
- ↑ Weyand, S; Kefala, G; Weiss, MS (30 de marzo de 2007). «The three-dimensional structure of N-succinyldiaminopimelate aminotransferase from Mycobacterium tuberculosis.». Journal of Molecular Biology 367 (3): 825-38. PMID 17292400. doi:10.1016/j.jmb.2007.01.023.
- ↑ Nocek, BP; Gillner, DM; Fan, Y; Holz, RC; Joachimiak, A (Apr 2, 2010). «Structural basis for catalysis by the mono- and dimetalated forms of the dapE-encoded N-succinyl-L,L-diaminopimelic acid desuccinylase.». Journal of Molecular Biology 397 (3): 617-26. PMC 2885003. PMID 20138056. doi:10.1016/j.jmb.2010.01.062.
- ↑ Pillai, B; Cherney, M; Diaper, CM; Sutherland, A; Blanchard, JS; Vederas, JC; James, MN (23 de noviembre de 2007). «Dynamics of catalysis revealed from the crystal structures of mutants of diaminopimelate epimerase.». Biochemical and Biophysical Research Communications 363 (3): 547-53. PMID 17889830. doi:10.1016/j.bbrc.2007.09.012.
- ↑ Gokulan, K; Rupp, B; Pavelka MS, Jr; Jacobs WR, Jr; Sacchettini, JC (16 de mayo de 2003). «Crystal structure of Mycobacterium tuberculosis diaminopimelate decarboxylase, an essential enzyme in bacterial lysine biosynthesis.». The Journal of Biological Chemistry 278 (20): 18588-96. PMID 12637582. doi:10.1074/jbc.M301549200.
- ↑ a b c Weaver, Robert F. (2005). Molecular biology (3rd edición). Boston: McGraw-Hill Higher Education. ISBN 978-0-07-284611-9.
- ↑ a b c d e Cooper, Geoffrey M. (2000). The cell : a molecular approach (2nd edición). Washington (DC): ASM Press. ISBN 978-0878931064.
- ↑ Jackson, R.J. (February 2010). «The mechanism of eukaryotic translation initiation and principles of its regulation». Molecular Cell Biology 10: 113-127.
- ↑ Green, Rachel; Harry F. Noller (1997). «Ribosomes and Translation». Annu. Rev. Biochem. 66: 679-716. PMID 9242921. doi:10.1146/annurev.biochem.66.1.679.
- ↑ a b c d Pestka (editors), Herbert Weissbach, Sidney (1977). Molecular Mechanisms of protein biosynthesis.. New York: Academic Press. ISBN 978-0127442501.
- ↑ Frank, J; Haixiao Gao (September 2007). «The process of mRNA–tRNA translocation». PNAS 104 (50): 19671-19678. PMC 2148355. PMID 18003906. doi:10.1073/pnas.0708517104.
- ↑ a b c Bandeali, Salman J.; Daye, Jad; Virani, Salim S. (30 de noviembre de 2013). «Novel Therapies for Treating Familial Hypercholesterolemia». Current Atherosclerosis Reports 16 (1): 382. PMID 24293346. doi:10.1007/s11883-013-0382-0.
- ↑ a b c Kang, Tae Hyuk; Park, Yongjin; Bader, Joel S.; Friedmann, Theodore; Cooney, Austin John (9 de octubre de 2013). «The Housekeeping Gene Hypoxanthine Guanine Phosphoribosyltransferase (HPRT) Regulates Multiple Developmental and Metabolic Pathways of Murine Embryonic Stem Cell Neuronal Differentiation». PLoS ONE 8 (10): e74967. PMC 3794013. PMID 24130677. doi:10.1371/journal.pone.0074967.
- ↑ a b c Walport, Ken Murphy, Paul Travers, Mark (2011). Janeway's Immunobiology (8. edición). Oxford: Taylor & Francis. ISBN 978-0815342434.
- ↑ a b Hughes, edited by Donald C. Lo, Robert E. (2010). Neurobiology of Huntington's disease : applications to drug discovery (2nd edición). Boca Raton: CRC Press/Taylor & Francis Group. ISBN 978-0849390005.
- ↑ Biglan, Kevin M.; Ross, Christopher A.; Langbehn, Douglas R.; Aylward, Elizabeth H.; Stout, Julie C.; Queller, Sarah; Carlozzi, Noelle E.; Duff, Kevin et al. (26 de junio de 2009). «Motor abnormalities in premanifest persons with Huntington's disease: The PREDICT-HD study». Movement Disorders 24 (12): 1763-1772. PMC 3048804. PMID 19562761. doi:10.1002/mds.22601.
 KSF
KSF![{\displaystyle {\ce {Reactante ->[][enzima] Producto}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f971373d74115be5f88323f79fe1e783898f513d)

![{\displaystyle {\ce {{Mol{\acute {e}}cula~precursora}+Cofactor->[][enzima]macromol{\acute {e}}cula}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/878fcfb41c2d0584dccf89d65b351b93ca3a1ba4)


