Borazano
 From Wikipedia (Es) - Reading time: 5 min
From Wikipedia (Es) - Reading time: 5 min
| Borazano | ||
|---|---|---|
| General | ||
| Fórmula estructural |
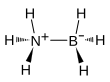 | |
| Fórmula molecular | ? | |
| Identificadores | ||
| Número CAS | 13774-81-7[1] | |
| ChemSpider | 4889282 | |
| PubChem | 6332567 | |
| Propiedades físicas | ||
| Masa molar | 28,035855 g/mol | |
Los borazanos o boranos de amoníaco[2] son, dentro de la química inorgánica, compuestos de boro y nitrógeno, con fórmula general R3B-NH2R. Las propiedades de los borazanos son análogas a las de los alcanos. Su uso es solo académico aunque es considerado una fuente potencial de combustible de hidrógeno debido a su alto porcentaje por masa molar de hidrógeno.[3]
Síntesis
[editar]La reacción de diborano con amoniaco da principalmente la sal de diamonio [H2 B(NH3)2]+ (BH4)−. El borano de amoníaco es el producto principal de esta reacción cuando se emplea un aducto de borano en lugar de diborano:[4]
- BH 3 (THF) + NH3 → BH3 NH3 + THF
Propiedades y estructura
[editar]La molécula adopta una estructura similar a la del etano, con el cual es isoelectrónica. La distancia del B − N es 1,58(2) Å. Por su parte, las distancias B − H y N − H son 1,15 y 0,96 Å, respectivamente. Su similitud con el etano es tenue ya que el borano de amoníaco es un sólido y el etano es un gas. Por ello, sus puntos de fusión difieren en 284 °C. Esta diferencia es consistente con la propiedad altamente polar del borano de amoníaco. Los átomos de hydrógeno enlazados al boro son hídricos, mientras los que están unidos al nitrógeno son de naturaleza algo ácidos.

La estructura del borazano en su estado sólido indica una estrecha asociación entre los centros NH y BH. La distancia H − H más cercana, aproximadamente 1,990 Å, equiparable con la distancia de enlace H − H de 0,74 Å. Esta interacción se llama enlace de dihidrógeno.[5][6] El análisis cristalográfico original de este compuesto invirtió las asignaciones de B y N. Se llegó a la estructura actualizada con datos mejorados utilizando la técnica de difracción de neutrones lo que permitió localizar a los átomos de hidrógeno con una mayor precisión.

| Molécula | Borano de amoníaco[7] | Aminoborano[8] | Iminoborano[9] |
|---|---|---|---|
| Fórmula | BNH 6 | BNH 4 | BNH 2 |
| Clase | amina-borano | aminoborano | iminoborano |
| hidrocarburo análogo | etano | etileno | acetileno |
| Clase de hidrocarburos análogos | alcano | alqueno | alquino |
| Estructura |  </img> </img>
| ||
| Modelo de bola y palo |  </img> </img>
|
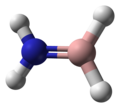 </img> </img>
|
|
| Hibridación de boro y nitrógeno. | sp 3 | sp 2 | sp |
| Longitud del enlace BN | 1,658 Å | 1,391 Å | 1,238 Å |
| Proporción de enlace simple BN | 100 % | 84 % | 75 % |
| Método de determinación de la estructura | espectroscopia de microondas | espectroscopia de microondas | espectroscopia infrarroja |
Usos
[editar]Se ha sugerido el borano de amoníaco es un medio de almacenamiento de hidrógeno. Por ejemplo, cuando en estado gaseoso se utiliza como combustible para vehículos de motor. Se puede hacer que el compuesto aducto libere hidrógeno al calentarse, polimerizándose primero en (NH2BH2) n, luego en (NHBH)n.[10] Finalmente se descompone en nitruro de boro (BN) a temperaturas superiores a 1000 °C.[11] El compuesto es más denso en hidrógeno que el hidrógeno líquido mismo y también puede existir a temperaturas y presiones normales.[12]
Compuestos análogos
[editar]Se han preparado diversos análogos del borano de amoníaco a partir de aminas primarias, secundarias e incluso terciarias :
- Borano terc-butilamina (t BuNH2 → BH3)
- Borano trimetilamina (Me3 N → BH3)
- Borano isopropilamina (i PrNH2 → BH3)
El primer aducto amino de borano se derivó a partir de la trimetilamina. El complejo de terc-butilamina de borano se prepara mediante la reacción de borohidruro de sodio con cloruro de t-butilamonio. Generalmente los aductos son más robustos con aminas más básicas. También son posibles variaciones del componente de boro, aunque los boranos primarios y secundarios suelen ser menos comunes.[13]
Referencias
[editar]- ↑ Número CAS
- ↑ Douglas, Bodie Eugene; Alexander, John J. (1987). Conceptos química inorgánica. Reverte. p. 651. ISBN 978-84-291-7153-2. Consultado el 15 de marzo de 2023.
- ↑ Fernández, Elena; Claver, Carmen; Bultó, Anna M. Masdeu; Godard, Cyril (30 de septiembre de 2014). Book of Abstracts XXXII Conference Expert Group Meeting on Organometallic Chemistry (en inglés). Publicacions Universitat Rovira I Virgili. p. 120. ISBN 978-84-8424-340-3. Consultado el 15 de marzo de 2023.
- ↑ Shore, S. G.; Boddeker, K. W. (1964). «Large Scale Synthesis of H2B(NH3)2+BH4− and H3NBH3». Inorganic Chemistry 3 (6): 914-915. doi:10.1021/ic50016a038.
- ↑ a b Klooster, W. T.; Koetzle, T. F.; Siegbahn, P. E. M.; Richardson, T. B.; Crabtree, R. H. (1999). «Study of the N-H···H-B Dihydrogen Bond Including the Crystal Structure of BH3NH3 by Neutron Diffraction». Journal of the American Chemical Society 121 (27): 6337-6343. doi:10.1021/ja9825332.
- ↑ Boese, R.; Niederprüm, N.; Bläser, D. (1992). Maksic, Z. B.; Eckert-Masic, M., eds. Molecules in Natural Science and Medicine. Chichester, England: Ellis Horwood. ISBN 978-0135615980.
- ↑ Thorne, L. R.; Suenram, R. D.; Lovas, F. J. (1983). «Microwave spectrum, torsional barrier, and structure of BH3NH3». J. Chem. Phys. 78 (1): 167-171. Bibcode:1983JChPh..78..167T. doi:10.1063/1.444528.
- ↑ Sugie, Masaaki; Takeo, Harutoshi; Matsumura, Chi (1987). «Microwave spectrum and molecular structure of aminoborane, BH2NH2». J. Mol. Spectrosc. 123 (2): 286-292. Bibcode:1987JMoSp.123..286S. doi:10.1016/0022-2852(87)90279-7.
- ↑ Kawashima, Yoshiyuki (1987). «Detection of HBNH by infrared diode laser spectroscopy». J. Chem. Phys. 87 (11): 6331-6333. Bibcode:1987JChPh..87.6331K. doi:10.1063/1.453462.
- ↑ Gutowski, M.; Autrey, T. (2006). «Features: Hydrogen gets onboard». Chemistry World 3 (3).
- ↑ Frueh, S.; Kellett, R.; Mallery, C.; Molter; T.; Willis, W. S.; King'ondu, C.; Suib, S. L. (2011). «Pyrolytic Decomposition of Ammonia Borane to Boron Nitride». Inorganic Chemistry 50 (3): 783-792. PMID 21182274. doi:10.1021/ic101020k.
- ↑ Stephens, F. H.; Pons, V.; Baker, R. T. (2007). «Ammonia–Borane: The Hydrogen Source par excellence?». Dalton Transactions 2007 (25): 2613-2626. PMID 17576485. doi:10.1039/b703053c.
- ↑ Staubitz, Anne; Robertson, Alasdair P. M.; Manners, Ian (2010). «Ammonia-Borane and Related Compounds as Dihydrogen Sources». Chemical Reviews 110 (7): 4079-4124. PMID 20672860. doi:10.1021/cr100088b.
 KSF
KSF