Sal (química)
 From Wikipedia (Es) - Reading time: 16 min
From Wikipedia (Es) - Reading time: 16 min
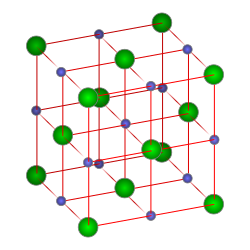

En química, una sal es un compuesto químico formado por cationes (iones con carga positiva) enlazados a aniones (iones con carga negativa) mediante un enlace iónico. Son el producto típico de una reacción química entre una base y un ácido,[1] donde la base proporciona el catión y el ácido al anión.
La combinación química entre un ácido y un hidróxido (base) o un óxido y un hidronio (ácido) origina una sal más líquida, lo que se denomina neutralización.
Un ejemplo es la sal de mesa, denominada en el lenguaje coloquial sal común o sal marina. Es la sal específica cloruro de sodio.[2] Su fórmula molecular es NaCl y es el producto de la base hidróxido sódico (NaOH) y ácido clorhídrico, HCl.
En general, las sales son compuestos iónicos que forman cristales. Son generalmente solubles en agua, donde se separan los dos iones. Las sales típicas tienen un punto de fusión alto, baja dureza, y baja compresibilidad. Fundidas o disueltas en agua, conducen la electricidad.
Lomonósov en sus Obras de Química y Física describió el concepto de "sal" [3][4] de la siguiente manera:
El nombre de la sal denota cuerpos frágiles que se disuelven en agua y permanece transparente; no se encienden si, en su forma pura, se exponen al fuego. Sus tipos: vitriolo y todas las demás sales metálicas, alumbre, bórax, tártaro, sales vegetales esenciales, sal tártara y potasa, sal de orina volátil, salitre, sal común de manantial, sal marina y de roca, amoníaco, sal de Epsom y otras sales obtenidas como resultado del trabajo químico.
Formación
[editar]Las sales están formadas por una reacción química entre:
- Una base y un ácido, por ejemplo, NH3 + HCl → NH4Cl
- Un metal y un ácido, por ejemplo, Mg + H2SO4 → MgSO4 + H2
- Un metal y un no metal, por ejemplo, Ca + Cl2 → CaCl2
- Una base y un anhídrido de ácido, por ejemplo, 2 NaOH + Cl2O → 2 NaClO + H2O
- Un ácido y una base anhídrido, por ejemplo, 2 HNO3 + Na2O → 2 NaNO3 + H2O
Las sales también pueden formarse si se mezclan soluciones de diferentes sales, sus iones se recombinan, y la nueva sal es insoluble y precipita (ver: equilibrio de solubilidad), por ejemplo:
Pb (NO3) 2 + Na2SO4 → PbSO4 ↓ + 2 NaNO3
Nomenclatura
[editar]Según la nomenclatura tradicional, las sales se denominan con el nombre del anión, con cierto prefijo y sufijo, seguido de la preposición de y el nombre del catión. Hay que distinguir entre distintos casos:
- En las sales de hidrácidos, se sustituye la terminación -hídrico del hidrácido del que proviene el anión para la terminación -uro. Por ejemplo, NaCl es el cloruro de sodio; el anión Cl- proviene del hidrácido HCl (ácido clorhídrico).
- En las sales de oxoácidos, se sustituye la terminación -oso o-ico del oxoácido del cual proviene el anión por la correspondiente - ito o -ato. Por ejemplo, el Ca3(PO4)2 es el fosfato de calcio; el anión PO43- proviene del H3PO4 (ácido fosfórico).H+OH-
- Las sales ácidas (sales que provienen de ácidos polipróticos y que contienen átomos de hidrógeno sustituibles) se denominan indicando el número de hidrógenos no sustituidos que quedan en la molécula, usando el prefijo correspondiente. Por ejemplo, el NaHS es la hidrogenosulfuro de sodio; el anión HS- proviene del ácido sulfhídrico.
- Las sales básicas (sales que contienen iones hidroxilo, OH-) se nombran indicando el número de hidroxilos seguido del anión central y finalmente el catión. Por ejemplo, el MgCl (OH) es el hidroxicloruro de magnesio.
- Las sales hidratadas (que contienen agua de cristalización) se denominan indicando la sal correspondiente y seguidamente el número de moléculas que piden ser tóxica y no tóxico.
Tipos de sal
[editar]Las sales se pueden clasificar de diversas formas. Las sales que producen iones de hidróxido cuando se disuelven en agua se denominan sales alcalinas. Las sales que producen soluciones ácidas son sales ácidas. Las sales neutras son aquellas sales que no son ni ácidas ni básicas. Los zwitteriones contienen un centro aniónico y catiónico en la misma molécula, pero no se consideran sales. Los ejemplos de zwitteriones incluyen aminoácidos, muchos metabolitos, péptidos y proteínas.[5]
Si consideramos las sales como productos de sustitución de cationes en ácidos o grupos hidroxo en bases , entonces se pueden distinguir los siguientes tipos de sales:[6]
- Las sales medias (normales) son los productos de la sustitución de todos los cationes hidrógeno de las moléculas de ácido por cationes metálicos (Na2CO3, K3PO4).
- Las sales ácidas son productos de la sustitución parcial de cationes de hidrógeno en ácidos con cationes metálicos. Las sales ácidas son una clase de sales que producen una solución ácida después de ser disueltas en un disolvente. Su formación como sustancia tiene una mayor conductividad eléctrica que la del disolvente puro.[7]
- Las sales básicas son productos de la sustitución incompleta de los grupos hidroxo básicos (OH-) > por residuos ácidos 2CO3. Se forman en condiciones de exceso de base o falta de ácido.
- Sales complejas Na2[Zn(OH)4
Según el número de cationes y aniones presentes en la estructura , se distinguen los siguientes tipos de sales:[6]
- Sales simples: sales que consisten en un tipo de catión y un tipo de anión: NaCl
- Las sales dobles son sales que contienen dos cationes diferentes: (SO4)2·12 H2O
- Las sales mixtas son sales que contienen dos aniones diferentes: Ca(OCl)Cl o cal de blanquear.
También distinga entre sales de hidratos ( hidratos cristalinos ), que incluyen moléculas de agua de cristalización , por ejemplo, Na2SO4·10 H2O y sales complejas que contienen un catión complejo o anión complejo K4[Fe(CN)6] Las sales internas están formadas por iones bipolares , es decir, moléculas que contienen átomos cargados positivamente y cargados negativamente.[6]
Propiedades
[editar]Propiedades físicas
[editar]
En general, las sales son materiales cristalinos con estructura iónica. Por ejemplo, los cristales de haluros de los metales alcalinos y alcalinotérreos (NaCl, CsCl, CaF2) formados por aniones, situados al principio del empaquetamiento esférico más denso, y cationes que ocupan huecos dentro del paquete. Cristales de sal iónicos pueden ser también formados a partir de residuos de ácido combinados en un sinfín de estructuras dimensionales aniónicos y fragmentos de estos con cationes en las cavidades (como los silicatos). Esta estructura se refleja apropiadamente en sus propiedades físicas: tienen altos puntos de fusión y en estado sólido son dieléctricos.[8]
También conocido son sales de estructura molecular (covalente) (por ejemplo, cloruro de aluminio AlCl3) En muchas sales, la naturaleza de los enlaces químicos es intermedia entre iónica y covalente.[6]
De particular interés son los líquidos iónicos, con puntos de fusión por debajo de 100 °C. Durante la fusión anormal de líquidos iónicos prácticamente no hay presión de vapor, pero si una alta viscosidad. Las propiedades especiales de estas sales se explican por la baja simetría del catión, la interacción débil entre los iones y una buena distribución de la carga del catión.[9]
Color
[editar]

Las sales pueden tener la apariencia de ser claras y transparentes (como el cloruro de sodio), opacas e incluso metálicas y brillantes (como la pirita o sulfuro de hierro). En muchos casos la opacidad o transparencia aparentes están relacionadas con la diferencia de tamaño de los monocristales individuales; como la luz se refleja en las fronteras de grano, los cristales grandes tienden a ser transparentes, mientras que los agregados policristalinos tienen la apariencia de polvo blanco.
Las sales pueden tener muchos colores diferentes. Algunos ejemplos son:
- Amarillo (cromato de sodio)
- Naranja (cromato de potasio)
- Rojo (ferricianuro de potasio)
- Malva (cloruro de cobalto(II))
- Azul (sulfato de cobre (II), azul de Prusia)
- Lila (permanganato de potasio)
- Verde (cloruro de níquel (II))
- Blanco (sulfato de magnesio)
- Negro (óxido de manganeso (IV))
- Sin color (cloruro de sodio)
La mayoría de minerales y pigmentos inorgánicos, así como muchos tintes orgánicos sintéticos, son sales. El color de la sal específica es debido a la presencia de electrones desparejados en el orbital atómico de los elementos de transición.
Gusto
[editar]Las diferentes sales pueden provocar todos los cinco diferentes sabores básicos como, por ejemplo, el salado (cloruro de sodio), el dulce (acetato de plomo (II), que provoca saturnismo si se ingiere), el agrio (bitartrato de potasio),[10] el amargo (sulfato de magnesio)[11] y el umami (glutamato monosódico).[12]
Olor
[editar]Las sales de ácidos fuertes y bases fuertes (sales fuertes), no suele ser volátiles y no tienen olor, mientras que las sales tanto de bases débiles como de ácidos débiles (sal débil), pueden tener olor en forma de ácido conjugado (por ejemplo, acetatos como el ácido acético o vinagre, y cianuros como el cianuro de hidrógeno en las almendras) o en forma de base conjugada (por ejemplo, sales de amonio como el amoniaco) de los iones componentes. Esta descomposición parcial y lenta es usualmente acelerada en presencia de agua, ya que la hidrólisis es la otra mitad de la ecuación de la reacción reversible de formación de las sales débiles.
Punto de fusión
[editar]Las sales tienen característicamente altos puntos de fusión. Por ejemplo, el cloruro de sodio se funde a 801 °C. Algunas sales con energías reticulares bajas son líquidas a temperatura ambiente o cerca de ella. Estos incluyen sales fundidas, que suelen ser mezclas de sales, y líquidos iónicos, que normalmente contienen cationes orgánicos. Estos líquidos presentan propiedades inusuales como disolventes.
Solubilidad
[editar]Muchos compuestos iónicos exhiben una solubilidad significativa en agua u otros disolventes polares. A diferencia de los compuestos moleculares, las sales se disocian en solución en componentes aniónicos y catiónicos. La energía de la red, las fuerzas cohesivas entre estos iones dentro de un sólido, determina la solubilidad. La solubilidad depende de qué tan bien interactúe cada ion con el solvente, por lo que ciertos patrones se hacen evidentes. Por ejemplo, las sales de sodio, potasio y amonio suelen ser solubles en agua. Las excepciones notables incluyen hexacloroplatinato de amonio y cobaltinitrito de potasio. La mayoría de los nitratos y muchos sulfatos son solubles en agua. Las excepciones incluyen sulfato de bario, sulfato de calcio (escasamente soluble) y sulfato de plomo (II), donde el emparejamiento 2+/2− conduce a energías reticulares elevadas. Por razones similares, la mayoría de los carbonatos metálicos no son solubles en agua. Algunas sales de carbonato solubles son: carbonato de sodio, carbonato de potasio y carbonato de amonio.
Conductividad
[editar]Las sales son aislantes característicos. Las sales fundidas o las soluciones de sales conducen la electricidad. Por esta razón, las sales licuadas (fundidas) y las soluciones que contienen sales disueltas (por ejemplo, cloruro de sodio en agua) pueden usarse como electrolitos.
Propiedades químicas
[editar]Las propiedades químicas vienen determinadas por las propiedades de los cationes y aniones o una parte de ellos.
Las sales reaccionan con los ácidos y las bases, obteniéndose el producto de reacción y un gas, precipitado o una sustancia tal como agua
Las sales reaccionan con los metales cuando este se libera de la sal de metal en una serie electroquímica de reactividad:
Las sales reaccionan entre sí y el producto resultante de la reacción (producen gas, y precipitan sedimentos o agua); estas reacciones pueden tener lugar con el cambio en los estados de oxidación de los átomos reactivos:
Algunas sales se descomponen cuando se calientan:
Disoluciones
[editar]Las sales son electrolitos fuertes. Al diluirse en agua se disocian por completo, en una reacción llamada hidrólisis. Generalmente afecta el pH de la disolución.[13]
Las disoluciones de sales que provienen de un ácido fuerte y una base fuerte forman una disolución neutra. Por ejemplo, la disolución del nitrato de sodio:
En esta clase de reacciones, el pH de la disolución es cercano a siete.[13]
Las disoluciones de sales provenientes de una base fuerte y un ácido débil son básicas, lo que significa que tienen un pH mayor a siete. Como ejemplo encontramos la disolución del acetato de sodio:[13]
Por el contrario, las disoluciones de sales de una base débil y un ácido fuerte son ácidas, y el pH resultante es menor a siete. Un ejemplo es la disolución del cloruro de amonio: Generalmente, todos los iones metálicos producen disoluciones ácidas.[13]
Si la disolución se produce con una sal proveniente de una base y un ácido débiles, entonces el resultado dependerá de las fuerzas relativas que primen en la reacción. Este comportamiento puede predecirse mediante la constante de disociación.[13]
Sal fuerte
[editar]Las sales fuertes o las sales de electrolitos fuertes son sales químicas compuestas de electrolitos fuertes. Estos compuestos iónicos se disocian completamente en agua. Generalmente son inodoros y no volátiles.
Las sales fuertes comienzan con Na__, K__, NH4__, o terminan con __NO3, __ClO4, or __CH3COO. La mayoría de los metales de los grupos 1 y 2 forman sales fuertes. Las sales fuertes son especialmente útiles cuando se crean compuestos conductores, ya que sus iones constituyentes permiten una mayor conductividad.[14]
Sal débil
[editar]Las sales débiles o "sales de electrolitos débiles" están, como sugiere el nombre, compuestas de electrolitos débiles. Generalmente son más volátiles que las sales fuertes. Pueden tener un olor similar al ácido o la base de los que se derivan. Por ejemplo, el acetato de sodio, NaCH3COO, huele similar al ácido acético CH3COOH.
Formación
[editar]
Las sales se forman por una reacción química entre:
- Una base y un ácido, por ejemplo, NH3 + HCl → NH4Cl
- Un metal y un ácido, por ejemplo, Mg + H2SO4 → MgSO4 + H2
- Un metal y un no metal, por ejemplo, Ca + Cl2 → CaCl2
- Una base y un anhídrido de ácido, por ejemplo, 2 NaOH + Cl2O → 2 NaClO + H2O
- Un ácido y una base anhidra, por ejemplo,2 HNO3 + Na2O → 2 NaNO3 + H2O
En la reacción de metátesis de sal, en la que se mezclan dos sales diferentes en agua, sus iones se recombinan y la nueva sal es insoluble y se precipita. Por ejemplo:
- Pb(NO3)2 + Na2SO4 → PbSO4↓ + 2 NaNO3
Clasificaciones
[editar]Las sales se pueden clasificar en los siguientes grupos:[15]
- Sal haloidea, hidrácida o binaria neutra: son compuestos binarios formados por un metal y un no-metal, sin ningún otro elemento. El anión siempre va a tener la terminación -uro. Ejemplos: cloruro de sodio, NaCl; cloruro de hierro (III), FeCl3; sulfuro de hierro (II), FeS.
- Sal de oxácido: procede de sustituir los hidrógenos de un oxácido por cationes metálicos.
- Sal oxácida, oxiácida o ternaria neutra: se sustituyen todos los hidrógenos. Ejemplo: hipoclorito de sodio, NaClO.
- Sal ácida: se sustituyen parte de los hidrógenos. Ejemplo: hidrogenocarbonato de sodio o bicarbonato de sodio, NaHCO3.
- Sal básica o hidroxisal: contienen iones hidróxido (OH-), además de otros aniones. Se pueden clasificar como sales o hidróxidos. Ejemplo: hidroxicarbonato de hierro (III), Fe(OH)CO3.
- Sal doble: se sustituyen los hidrógenos por dos o más cationes. Ejemplo: carbonato doble de potasio y litio, KLiCO3.
- Hidroxosal: sal formada a partir de un hidróxido anfótero, que reacciona como un ácido una base débil ante una base o un ácido fuerte.
- Al(OH)3 + 3 Na(OH) → Al(OH)6Na3 (hexahidroxoaluminato de sodio)
- Al(OH)3 + 3 HCl → AlCl3 (cloruro de aluminio) + 3 H2O
- Sal mixta: contiene varios aniones. Ejemplos: clorurofluoruro de calcio, CaClF; clorurofosfato de potasio, K4ClPO4, nitratosulfato de hierro (III), Fe(NO3)SO4.
- Oxisal: formada por la unión de un óxido y una sal. Ejemplos: oxinitrato de plomo (IV), PbO(NO3)2; oxicloruro de cobalto (III), CoOCl.
- Sal hidratada o hidrato: sal con moléculas de agua en su estructura cristalina. Ejemplos: óxido de plomo (II) hemihidrato (o hemihidratado), PbO·½H2O; sulfato de calcio dihidrato, CaSO4·2H2O.
Como puede verse en la clasificación de arriba, tanto las sales haloideas como las sales oxácidas, son llamadas «sales neutras» las sales naturales son las que comúnmente conocemos.
Localización
[editar]Las sales se encuentran o bien en forma de mineral como parte de las rocas (como la halita), o bien disueltas en el agua (por ejemplo, el agua de mar). Son un componente vital de los seres vivos, en los que las podemos encontrar de diferentes formas:
- Disueltas dentro de los organismos en los iones que las constituyen, los cuales pueden actuar en determinados procesos biológicos:
- Transmisión de los impulsos nerviosos
- Contracción muscular
- Síntesis y actividad de la clorofila
- Transporte del oxígeno de la hemoglobina
- Cofactores que ayudan a las enzimas
- Formando parte de estructuras sólidas insolubles que proporcionan protección o sostenimiento (huesos, conchas...)
- Asociadas a moléculas orgánicas: hay iones que son imprescindibles para la síntesis de algunas biomoléculas (como por ejemplo el yodo para las hormonas fabricadas en la glándula tiroides), o para determinadas funciones (por ejemplo, el ion fosfato asociado a lípidos forma los fosfolípidos de la membrana celular; fosfoproteínas como la caseína de la leche, la molécula de hemoglobina que contiene hierro ...)
Soluciones salinas
[editar]- Una solución salina es el resultado de la reacción de un ácido fuerte con una base fuerte. Resulta altamente ionizada y, por ello, neutra. La explicación es que los contra iones de los ácidos fuertes y las bases débiles son bastante estables, y por tanto no hidrolizan al agua. Un ejemplo sería el cloruro sódico, el bromuro de litio y otras.
- Una solución salina de un ácido fuerte con una base débil es ácida. Esto es así porque, tras disociarse la sal al disolverse, la base débil tiene tendencia a captar OH-, hidróxidos que va a obtener hidrolizando el agua. Finalmente, tenemos un exceso de iones hidronio en disolución que le confieren acidez a la disolución. A más débil la base, más ácida será la disolución resultante.
- Químicamente: Una solución salina de un ácido débil con una base fuerte es básica. El mecanismo es el mismo que en caso anterior: el ácido, al ser débil, tenderá a captar un protón, que debe proceder necesariamente de la hidrólisis del agua. Un ejemplo, la disolución en agua del acetato de sodio.
- Comúnmente se le llama solución salina a la mezcla de sal común(NaCl) y agua, en esta mezcla la sal
Aplicación de las sales
[editar]Las sales son omnipresentes tanto en la fabricación de diversos productos, como en la vida cotidiana.
- Sales de ácido clorhídrico. De los cloruros los más utilizados son el cloruro de sodio y el cloruro de potasio.
Cloruro de sodio (sal de mesa)] se extrae del agua de los lagos y del mar y también se extrae de las minas de sal. La sal de cocina se utiliza en los alimentos. En la industria, el cloruro de sodio sirve como materia prima para el cloroa, el hidróxido de sodio y el carbonato ácido de sodio.
El cloruro de potasio se utiliza en la agricultura como fertilizante potásico. - Sales de ácido sulfúrico En la construcción y en la medicina se utiliza mucho el yeso semiacuático obtenido por cocción de la roca (sulfato de calcio dihidratado). Cuando se mezcla con agua, se solidifica rápidamente para formar sulfato de calcio dihidrato, es decir, yeso.
El sulfato decahidratado se utiliza como materia prima para la producción de soda. - Sales de ácido nítrico Los nitratos son los más utilizados como fertilizantes en la agricultura. Los más importantes son el nitrato de sodio, el nitrato de potasio, el nitrato de calcio y el nitrato de amonio. Estas sales suelen llamarse salitre.
- De los ortofosfatos, el más importante es el ortofosfato de calcio. Esta sal es el principal constituyente de los minerales fosforita y apatita. La fosforita y la apatita se utilizan como materias primas en la producción de fertilizantes fosfatados, como el superfosfato y el precipitado.
- Sales de ácido carbónico El carbonato de calcio se utiliza como materia prima para la producción de cal.
carbonato de sodio (sosa) se utiliza en la producción de vidrio y en la cocción de jabones.
carbonato de calcio también se encuentra de forma natural como piedra caliza, tiza y mármola.
Galería de imágenes con sal
[editar]Véase también
[editar]- Sales minerales.
- Sal doble
- Solubilidad
- Hidrólisis
- Sal ácida
- Carboxilato
- Halogenuro
- Hipertensión
- Enlace iónico
- Sal kosher
- Natrón
- Antigua ruta de la sal
- Salinidad
- Salar la tierra
- Sal marina
- Sal común
- Teoría ácido-base de Brønsted-Lowry
- Compuesto iónico
Referencias
[editar]- ↑ Skoog, D.A; West, D.M.; Holler, J.F.; Crouch, S.R. (2004). Fundamentals of Analytical Chemistry; Chapters 14, 15 and 16 (8th edición). Thomson Brooks/Cole. ISBN 0-03-035523-0.
- ↑ Chang, Raymond. Química (Séptima edición). p. 68. ISBN 9786071509284.
- ↑ M.V. Lomonosov. Trabaja en química y física . Museo histórico y conmemorativo de Lomonosov. Consultado el 24 de octubre de 2013.
- ↑ M.V. Lomonosov. Una introducción a la verdadera química física . Biblioteca electrónica fundamental. - Párrafo 111. Consultado el 24 de octubre de 2013.
- ↑ Voet, D.; Voet, J. G. (2005). Biochemistry (en inglés) (3rd edición). Hoboken, NJ: John Wiley & Sons Inc. p. 68. ISBN 9780471193500. Archivado desde el original el 11 de septiembre de 2007.
- ↑ a b c d Enciclopedia química / Ed. N. S. Zefirova. - M .: Gran enciclopedia rusa, 1995 .-- T. 4. - ISBN 5-85270-092-4 .
- ↑ Cady, H. P.; Elsey, H. M. (1928). «A general definition of acids, bases, and salts». Journal of Chemical Education 5 (11): 1425. Bibcode:1928JChEd...5.1425C. doi:10.1021/ed005p1425.
- ↑ Knuni ︠ a ︡ nt ︠ s ︡, Gl. red. I. L. (1990). Khimicheskai ︠ a ︡ ENT ︠ s ︡ iklopedii ︠ a ︡ (en ruso). Moscú: Sovetskai ︠ a ︡ ENT ︠ s ︡ iklopedii ︠ a ︡. ISBN 5-85270-035-5.
- ↑ Wasserscheid P., Keim W. (2000). «Ionic Liquids-New "Solutions" for Transition Metal Catalysis». Angew. Chem. Int. Ed (en inglés) 39 (21). PMID 11091453. doi:10.1002/1521-3773(20001103)39:21.
- ↑ Crawford, Nicole (20 de noviembre de 2017). «Ácido tartárico versus cremor tártaro». Vinetur. Consultado el 18 de julio de 2021.
- ↑ «SULFATO MAGNESIO HEPTAHIDRATADO PURO [ 1.000 kgr]». Cosmo Tienda. Consultado el 18 de julio de 2021.
- ↑ «Descubrimiento de umami y glutamato monosódico». glutamate.org. 2021. Consultado el 18 de julio de 2021.
- ↑ a b c d e Chang, Raymond. Química (Séptima edición). pp. 689-693. ISBN 9786071509284.
- ↑ «Acid and Base Strength». Home Bookshelves Physical & Theoretical Chemistry Supplemental Modules (Physical and Theoretical Chemistry) Acids and Bases Ionization Constants. MindTouch and Department of Education Open Textbook Pilot Project. 5 de junio de 2019. Archivado desde el original el 13 de diciembre de 2016. Consultado el 6 de noviembre de 2019.
- ↑ Martínez Lorenzo, Antonio (1997). Formulación química IUPAC. Editorial Bruño. ISBN 84-216-0874-6.
Bibliografía
[editar]- Girichev G.V. Estructura molecular de sales de ácidos que contienen oxígeno // Revista educativa Soros . - 1999. - No. 11 . - S. 40-44 .
- Lidin R.A., Molochko V.A., Andreeva L.L., Tsvetkov A.A. Fundamentos de la nomenclatura de sustancias inorgánicas / Ed. B.D. Stepin. - M .: Química, 1983 .-- 112 p.
- Enciclopedia química / Ed. N. S. Zefirova. - M .: Gran enciclopedia rusa, 1995 .-- T. 4. - ISBN 5-85270-092-4 .
 KSF
KSF

















