Plutonium
 From Wikipedia (Fr) - Reading time: 46 min
From Wikipedia (Fr) - Reading time: 46 min
Le plutonium est l'élément chimique de symbole Pu et de numéro atomique 94. C'est un métal radioactif transuranien de la famille des actinides. Il se présente sous la forme d'un solide cristallisé dont les surfaces fraîches sont gris argenté mais se couvrent en quelques minutes, en présence d'humidité, d'une couche terne de couleur grise, tirant parfois sur le vert olive, constituée d'oxydes et d'hydrures ; l'accroissement de volume qui en résulte peut atteindre 70 % d'un bloc de plutonium pur, et la substance ainsi formée tend à se désagréger en une poudre pyrophorique.
Le plutonium a été produit et isolé pour la première fois le à l'université de Californie à Berkeley en bombardant de l'uranium 238 par du deutérium. Venant à la suite de l'uranium et du neptunium dans le tableau périodique, ce nouvel élément chimique a été nommé en référence à Pluton, qui vient à la suite des planètes Uranus et Neptune dans le Système solaire. C'est un élément synthétique, produit artificiellement par l'homme, mais on rapporte également l'observation de traces de plutonium naturel dans des minerais d'uranium. Il s'agit d'un métal lourd radiotoxique qui tend à s'accumuler dans les os et, dans une moindre mesure, dans le foie. On observe couramment quatre états d'oxydation du plutonium, de +3 à +6 (l'état +7 est rare), avec des colorations distinctes. La structure électronique du métal pur est déterminée par la bande 5f, qui présente la plus grande densité d'états au niveau de Fermi ; particulièrement étroite, la bande 5f tend à localiser les électrons qui s'y trouvent, de sorte que le plutonium pur à température ambiante est semblable aux matériaux à fermions lourds, avec une capacité thermique et une résistivité électrique élevées.
On connaît pas moins de six allotropes du plutonium à pression atmosphérique, et un septième au-delà de 60 MPa. Ils ont des propriétés bien tranchées et souvent inhabituelles pour un métal. Ainsi, le plutonium α, stable à température ambiante, est l'un des très rares métaux à cristalliser dans le système monoclinique ; ses propriétés physiques et structurelles relèvent davantage des minéraux que des métaux usuels, tandis que ses propriétés mécaniques rappellent celles de la fonte. Le plutonium δ, stable à température plus élevée ou avec une faible fraction molaire de gallium, cristallise en revanche dans une maille cubique à faces centrées, avec une masse volumique inférieure de près de 20 % à celle du plutonium α ; il est davantage métallique, avec des propriétés mécaniques semblables à l'aluminium, mais un coefficient de dilatation thermique négatif (il se contracte en chauffant). Le plutonium est également l'un des rares éléments chimiques dont le liquide est plus dense que le solide au point de fusion. L'existence de multiples allotropes aux énergies internes voisines rend la mise en forme du plutonium particulièrement délicate, au point qu'on utilise plutôt un alliage plutonium-gallium, qui stabilise la phase δ à température ambiante, ce qui facilite l'usinage des pièces en plutonium.
Le plutonium 239 et le plutonium 241 sont des isotopes fissiles par neutrons thermiques, ce qui signifie qu'ils peuvent contribuer à une réaction nucléaire en chaîne et qu'ils peuvent être utilisés dans la conception d'armes nucléaires et de réacteurs nucléaires. Le plutonium 240 présente un taux de fission spontanée très élevé qui impose d'en maintenir un taux inférieur à 7 % dans le plutonium de qualité militaire. Le plutonium 238 a une demi-vie de 88 ans et émet des particules α ; c'est une source de chaleur souvent utilisée par les générateurs thermoélectriques à radioisotopes pour alimenter certaines sondes spatiales en électricité. La séparation des isotopes du plutonium est difficile et ils sont généralement produits spécifiquement par des réacteurs spécialisés. La production de plutonium en quantité suffisante a été l'un des objectifs du projet Manhattan au cours de la Seconde Guerre mondiale afin de développer les premières bombes nucléaires. La première explosion atomique, l'essai Trinity, a utilisé une charge en plutonium, de même que Fat Man, la bombe atomique larguée sur Nagasaki ; la bombe Little Boy larguée trois jours plus tôt sur Hiroshima avait quant à elle un cœur en uranium enrichi.
Propriétés
[modifier | modifier le code]-
Plutonium vu par la tranche sur le salt cake issu du procédé multicycle de réduction directe d'oxyde (MCDOR) : le dioxyde de plutonium PuO2 est dissous dans le chlorure de calcium CaCl2 fondu de 820 à 875 °C dans un creuset en oxyde de magnésium MgO pour y être réduit en plutonium métallique[5].
Physique
[modifier | modifier le code]Le plutonium est un métal de la famille des actinides présentant, comme la plupart des autres métaux, un aspect argenté brillant comme le nickel. Cependant, au contact de l'air, il se recouvre rapidement d'une couche terne grisâtre, avec des couleurs pouvant tirer sur le jaune ou le vert olive, cette dernière teinte provenant du dioxyde de plutonium[6] PuO2.
Comme le neptunium et l'uranium — et, dans une moindre mesure, le protactinium — la structure électronique du plutonium aux conditions normales de température et de pression est déterminée par les orbitales 5f, qui contribuent de manière prépondérante aux liaisons interatomiques. Les distances entre atomes s'en trouvent réduites dans ces matériaux, qui présentent de ce fait une masse volumique particulièrement élevée : celle du plutonium vaut 19,816 g/cm3, plus du double de celle de l'einsteinium (8,84 g/cm3), qui a pourtant une masse atomique supérieure. Or les distances interatomiques dans un cristal influencent la largeur des bandes électroniques : plus ces distances sont petites, plus les bandes sont étroites. La bande 5f étant mathématiquement moins large que les bandes 6d et 7s, elle devient ici suffisamment étroite pour tendre à localiser les électrons dans le cristal, dont les propriétés métalliques sont par conséquent fortement dégradées[7]. De là provient toute la complexité du plutonium : compte tenu de la structure de bandes très particulière du matériau, où les bandes 5f et 6d ont des niveaux d'énergie très voisins, les électrons 5f du plutonium sont à la limite entre état localisé et état délocalisé dans le cristal, de sorte qu'une légère variation d'énergie interne suffit pour passer de l'un à l'autre, ce qui se traduit par des modifications brutales des propriétés macroscopiques du matériau.
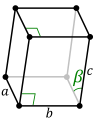
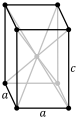
Conséquence de l'influence des électrons 5f, les cristaux des actinides légers sont moins symétriques que ceux des métaux usuels, car les orbitales 5f sont très directionnelles[8], et contraignent la géométrie des cristaux. Le protactinium cristallise dans le système quadratique, moins symétrique que ceux des métaux usuels, tandis que l'uranium et le neptunium cristallisent dans le système orthorhombique, encore moins symétrique, et que le plutonium cristallise dans le système monoclinique, le moins symétrique de tous. Il s'ensuit que le plutonium à l'état standard est peu ductile, peu malléable, peu plastique, et est au contraire plutôt dur et fragile ; on compare souvent ses propriétés mécaniques à celles de la fonte grise[9].
Autre conséquence de l'influence des électrons 5f, le plutonium à l'état standard présente une faible conductivité électrique et une faible conductivité thermique, mais une capacité thermique élevée, ce qui l'apparente aux matériaux à fermions lourds[7]. De plus, sa conductivité électrique tend à décroître lorsqu'on refroidit le matériau[10], ce qui est à l'opposé du comportement habituel des métaux. La tendance s'observe jusqu'à 100 K, puis s'inverse pour le plutonium frais ; la résistivité croît cependant avec le temps en raison des dommages au réseau cristallin dus à la radioactivité.
| Métal | Conductivité thermique |
Résistivité électrique |
Compressibilité | Module de Young |
|---|---|---|---|---|
| Plutonium α | 4,2 W/m/K | 1,45 µΩ m | 0,020 GPa−1 | 100 GPa |
| Plutonium δ (Pu-Ga) | 9,2 W/m/K | 1,00 µΩ m | 0,033 GPa−1 | 42 GPa |
| Acier inoxydable | 15 W/m/K | 0,7 µΩ m | 0,000 7 GPa−1 | 180 GPa |
| Aluminium | 222 W/m/K | 0,029 µΩ m | 0,015 GPa-1 | 70 GPa |
D'une manière générale, la radioactivité désorganise la structure cristalline du plutonium par accumulation de défauts cristallins[8]. Cependant, l'auto-irradiation peut également chauffer suffisamment le matériau pour conduire à un recuit, ce qui contrebalance l'effet précédent pour des températures supérieures à 1 000 K[12].
Isotopes
[modifier | modifier le code]
On connaît une vingtaine d'isotopes du plutonium. Le plutonium 244 présente la demi-vie la plus longue, avec 80,8 millions d'années, suivi par le plutonium 242, avec 373 300 ans, et le plutonium 239, avec 24 110 ans. Tous les autres isotopes du plutonium ont une demi-vie inférieure à 7 000 ans. Le plutonium présente également huit isomères nucléaires, dont la demi-vie est toujours inférieure à une seconde[14].
Les isotopes connus du plutonium ont une masse atomique allant de 228 à 247. Le mode de désintégration privilégié des isotopes plus légers que le plutonium 244 est la fission spontanée et la désintégration α, qui produit essentiellement du neptunium et de l'uranium, ainsi qu'une grande variété de produits de fission. Le mode de désintégration privilégié des isotopes plus lourds que le plutonium 244 est la désintégration β, qui produit essentiellement de l'américium. Le plutonium 241 est l'isotope parent de la série de désintégration du neptunium, qui donne de l'américium 241 par désintégration β[14],[15].
Le plutonium 239 est, avec l'uranium 233 et l'uranium 235, l'un des trois principaux isotopes fissiles utilisés par l'industrie nucléaire ou à des fins militaires. Le plutonium 241 est également fortement fissile, c'est-à-dire qu'il peut fissionner sous l'impact d'un neutron thermique en libérant suffisamment d'autres neutrons pour permettre la fission d'autres atomes et entretenir ainsi une réaction en chaîne ; il est cependant bien plus radioactif que le plutonium 239, et produit, par désintégration β, de l'américium 241, un fort émetteur de particules α indésirables dans les applications habituelles du plutonium. Soumis à des neutrons thermiques, les isotopes 239Pu et 241Pu ont une probabilité d'environ 3⁄4 de fissionner et d'environ 1⁄4 de donner du 240Pu et du 242Pu respectivement, de sorte que le taux de 240Pu dans le plutonium résiduel après une réaction nucléaire est supérieur à celui du plutonium initial.
Sensiblement moins radioactif que la plupart des autres isotopes, le plutonium 239 pur présente cependant un facteur de multiplication keff supérieur à 1, ce qui signifie que ce matériau peut atteindre la masse critique pour peu qu'une quantité suffisante de matière soit rassemblée dans le volume approprié[16]. Au cours de la fission d'un atome, une fraction de l'énergie de liaison nucléaire, qui assure la cohésion du noyau atomique, est libérée sous forme d'énergie électromagnétique et d'énergie cinétique, cette dernière étant rapidement convertie en énergie thermique. La fission d'un kilogramme de plutonium 239 peut produire une explosion équivalente à 21 kt de TNT (88 000 GJ). C'est cette énergie qui est utilisée par les réacteurs nucléaires et les armes nucléaires[15].
La présence de plutonium 240 dans une masse de plutonium 239 limite l'intérêt militaire de celui-ci car cet isotope présente un taux de fission spontanée supérieur de plus de quatre ordres de grandeur à celui du plutonium 239 — environ 440 fissions/s/g, soit plus de 1 000 neutrons/s/g[17] — ce qui dégrade les performances explosives du matériau et accroît les risques d'explosion incontrôlée[18]. Le plutonium est dit de qualité militaire (weapon-grade) lorsqu'il contient moins de 7 % de plutonium 240, et de qualité combustible (fuel-grade) lorsqu'il en contient moins de 19 %. Le plutonium haute qualité (supergrade), contenant moins de 4 % de plutonium 240, est utilisé, en raison de sa plus faible radioactivité, pour les armes nucléaires devant être conservées à proximité immédiate des équipages, dans les sous-marins nucléaires lanceurs d'engins et les divers types de navires de guerre par exemple[19]. Le plutonium 238 n'est pas fissile mais peut facilement être fissionné sous l'effet de neutrons rapides ainsi que d'une radioactivité α[15].

Les deux principaux isotopes synthétisés sont le plutonium 238 et le plutonium 239[15]. Le plutonium 239 est produit par capture neutronique puis désintégration β à partir d'uranium 238[20] :
Les neutrons issus de la fission de l'uranium 235 sont absorbés par les noyaux d'uranium 238 pour former de l'uranium 239 ; une désintégration β convertit alors un neutron en proton pour former du neptunium 239, converti par une seconde désintégration β en plutonium 239.
Le plutonium 238 est produit par bombardement d'uranium 238 avec des ions de deutérium[21] :
Radioactivité
[modifier | modifier le code]Hormis le plutonium 240, qui présente un fort taux de fission spontanée, et le plutonium 241, qui se désintègre par radioactivité β, la désintégration spontanée des principaux isotopes du plutonium se fait essentiellement par radioactivité α, c'est-à-dire par émission de particules α (He2+) qui se recombinent avec des électrons du métal pour former de l'hélium, tandis que le plutonium est transmuté en uranium. Ainsi, un cœur typique d'arme nucléaire de 5 kg contient 12,5 × 1024 atomes donnant une activité de 11,5 × 1012 Bq (désintégrations par seconde) émettant des particules α, ce qui correspond globalement à une puissance de 9,68 W [22],[23].
Modes de désintégration principaux d'isotopes du plutonium[24] Isotope Période radioactive
Activité
massiqueMode de
désintégrationNucléide
filsRapport de
branchementÉnergie de
désintégration238Pu 87,76 ans 6,34 × 1011 Bq/g Radioactivité α 234U 71,04 % 5,499 MeV 28,84 % 5,457 MeV 239Pu 24 130 ans 2,295 × 109 Bq/g Radioactivité α 235U 73,30 % 5,156 MeV 15,10 % 5,144 MeV 11,45 % 5,106 MeV 240Pu 6 567,5 ans 8,40 × 109 Bq/g Radioactivité α 236U 72,90 % 5,168 MeV 27,00 % 5,124 MeV 241Pu 14,29 ans 3,81 × 1012 Bq/g Radioactivité β 241Am 99,99 % 20,81 keV
Les radioisotopes du plutonium libèrent une chaleur de désintégration variable selon les isotopes considérés. Cette grandeur est généralement donnée en watts par kilogramme ou en milliwatts par gramme. Elle peut atteindre des valeurs significatives dans les pièces en plutonium de grande taille (par exemple, dans les têtes nucléaires). Tous les isotopes du plutonium libèrent également de faibles rayons γ.
Chaleur de désintégration d'isotopes du plutonium[25] Isotope Chaleur de désintégration Fission spontanée (neutrons) Remarques 238Pu 560 W/kg 2 600 g−1 s−1 Chaleur de désintégration très élevée mise à profit dans les générateurs thermoélectriques à radioisotope 239Pu 1,9 W/kg 0,022 g−1 s−1 Principal isotope fissile du plutonium. 240Pu 6,8 W/kg 910 g−1 s−1 Principale impureté du plutonium 239. La qualité d'un plutonium est généralement exprimée en pourcentage de 240Pu. Son taux de fission spontanée est défavorable aux applications militaires. 241Pu 4,2 W/kg 0,049 g−1 s−1 Se désintègre en américium 241. Son accumulation présente un risque d'irradiation par les pièces de plutonium anciennes. 242Pu 0,1 W/kg 1 700 g−1 s−1
Allotropes
[modifier | modifier le code]
Il existe six allotropes du plutonium à pression atmosphérique, et un septième au-delà de 60 MPa[8]. Ces allotropes ont une énergie interne qui varie peu tandis que leurs propriétés physiques varient de façon spectaculaire. La masse volumique du plutonium pur à pression atmosphérique vaut ainsi 19,86 g/cm3 pour le plutonium α à température ambiante, mais seulement 15,92 g/cm3 pour le plutonium δ à 125 °C[26], soit une densité 20 % plus faible, correspondant à un allongement linéaire de plus de 7,6 %. Le plutonium peut ainsi réagir violemment à des changements de pression, de température ou d'environnement chimique, et les transitions de phase peuvent s'accompagner de changements de volume significatifs et brutaux[8].
Phases du plutonium à pression atmosphérique[26] Phase Système cristallin Température de
transition de phaseMasse volumique[a] α Monoclinique simple —[b] 19,86 g/cm3 β Monoclinique à bases centrées 124,5 °C 17,70 g/cm3 γ Orthorhombique à faces centrées 214,8 °C 17,14 g/cm3 δ Cubique à faces centrées 320,0 °C 15,92 g/cm3 δ’ Quadratique centré 462,9 °C 16,00 g/cm3 ε Cubique centré 482,6 °C 16,51 g/cm3 Liquide ~640 °C 16,65 g/cm3
- Systèmes cristallins du plutonium pur
-
Monoclinique (α)
-
Monoclinique à bases centrées (β)
-
Orthorhombique à faces centrées (γ)
-
Tétragonal centré (δ’)
-
Cubique centré (ε)
L'existence d'allotropes aussi différents pour des énergies internes aussi voisines rend la mise en forme du plutonium pur particulièrement délicate. Son état standard, la phase α, est monoclinique, faisant du plutonium pur à température ambiante un matériau dur et cassant comme la fonte grise, qui se prête fort peu à l'usinage et est susceptible de connaître de brusques variations de géométrie sous l'effet d'échauffements modérés. En revanche, la phase δ est cubique à faces centrées, comme de nombreux métaux usuels tels que l'aluminium et le nickel, et présente des propriétés mécaniques semblables à celles de l'aluminium. Stable de 320,0 à 462,9 °C pour le plutonium pur, la phase δ peut être stabilisée jusqu'à température ambiante moyennant l'adjonction d'une petite quantité de gallium, d'aluminium, d'américium, de scandium ou de cérium, qui permet d'usiner et de souder des pièces en plutonium[10]. L'alliage plutonium-gallium est fréquemment utilisé à cet effet, car il permet de s'affranchir des transitions de phases non désirées entraînant des distorsions dues à des gonflements ou des contractions localisés dans la pièce. Le silicium, l'indium, le zinc et le zirconium permettent la formation d'une phase δ métastable par refroidissement rapide. L'adjonction de grandes quantités d'hafnium, d'holmium et de thallium permet également de préserver la phase δ jusqu'à la température ambiante. Le neptunium est le seul élément qui stabilise la phase α monoclinique à température plus élevée[8].
L'élasticité de la phase δ est anisotrope, pouvant varier d'un facteur six à sept selon les directions[27].
Dans les armes à fission, l'onde de choc qui comprime le noyau (au-delà de quelques dizaines de kilobars) provoque également une transition de la phase δ vers la forme α, nettement plus dense, ce qui permet d'atteindre plus facilement la criticité[27].
Alliages
[modifier | modifier le code]Les alliages de plutonium peuvent être obtenus en ajoutant un métal à du plutonium fondu. Si le métal ajouté est suffisamment réducteur, le plutonium peut être apporté sous forme d'oxydes ou d'halogénures. L'alliage plutonium-gallium et l'alliage plutonium-aluminium, qui stabilisent la phase δ du plutonium à température ambiante, sont obtenus en ajoutant du trifluorure de plutonium PuF3 à du gallium ou de l'aluminium fondus, ce qui présente l'avantage d'éviter de manipuler du plutonium métallique, très réactif[28].
- Plutonium-gallium Pu-Ga — Alliage principal utilisé pour la mise en forme, l'usinage et le soudage de pièces en plutonium en évitant les problèmes structurels posés par les transitions de phases α–δ. Il est utilisé principalement pour la réalisation d'armes nucléaires à implosion[29].
- Plutonium-aluminium Pu-Al — Alternative à l'alliage plutonium-gallium, mais tend à interagir avec les particules α en émettant des neutrons, ce qui réduit son intérêt pour réaliser des armes nucléaires. Il peut en revanche être utilisé pour réaliser du combustible nucléaire[30].
- Plutonium-gallium-cobalt PuCoGa5 — Supraconducteur non conventionnel présentant une supraconductivité en dessous de 18,5 K, un ordre de grandeur au-dessus du plus élevé des systèmes à fermions lourds, et avec un courant critique élevé.
- Plutonium-cérium Pu-Ce et plutonium-cérium-cobalt Pu-Ce-Co — Peuvent être utilisés comme combustibles nucléaires.
- Uranium-plutonium U-Pu — Avec environ 15 à 30 % d'atomes de plutonium, cet alliage peut être utilisé comme combustible nucléaire pour surgénérateurs. Il est pyrophorique et très sensible à la corrosion au point de s'enflammer ou de se désintégrer au contact de l'air, ce qui nécessite de l'allier à d'autres constituants. L'addition d'aluminium, de carbone ou de cuivre n'apporte aucune amélioration notable, tandis que le zirconium et le fer améliorent la résistance à la corrosion, mais ne permettent pas d'éviter la désintégration après plusieurs mois d'exposition à l'air. L'addition de titane ou de zirconium élève le point de fusion de l'alliage[31].
- Uranium-plutonium-zirconium U-Pu-Zr — Peut être utilisé comme combustible nucléaire, notamment pour surgénérateurs[32],[33]. Le titane et le zirconium accroissent la résistance à la corrosion, réduisent l'inflammabilité et améliorent la ductilité, la résistance, l'usinabilité et les caractéristiques thermiques. L'alliage uranium-plutonium-molybdène U-Pu-Mo présente la meilleure résistance à la corrosion, mais le titane et le zirconium sont préférés au molybdène en raison de meilleures propriétés physiques[31].
- Thorium-uranium-plutonium Th-U-Pu — Étudié comme possible combustible nucléaire pour surgénérateurs[31].
Chimie
[modifier | modifier le code]
Le plutonium pur à température ambiante présente des surfaces argentées qui ternissent en quelques minutes au contact de l'air[15]. Il présente quatre états d'oxydation courants en solution aqueuse, plus un cinquième plus rare[35] :
- Pu(III), sous forme d'ion Pu3+ (bleu lavande)
- Pu(IV), sous forme d'ion Pu4+ (brun jaune)
- Pu(V), sous forme d'ion PuO2+ (rose pâle)[c]
- Pu(VI), sous forme d'ion PuO22+ (rose orangé)
- Pu(VII), sous forme d'ion PuO53− (vert ; cet ion heptavalent est rare).
Un complexe avec du plutonium à l'état d'oxydation formel +2, le [K(2.2.2-cryptand)][PuIICp″3], où Cp″ = C5H3(SiMe3)2, a également été publié[37].
La couleur des solutions d'ions de plutonium dépend à la fois de l'état d'oxydation et de la nature de l'anion acide[38]. C'est ce dernier qui influence le degré de complexation du plutonium.
Le plutonium métallique est obtenu en faisant réagir du tétrafluorure de plutonium PuF4 avec du baryum, du calcium ou du lithium à 1 200 °C[39]. Il est attaqué par les acides, l'oxygène et la vapeur d'eau, mais pas par les bases. Il se dissout facilement dans l'acide chlorhydrique HCl, l'acide iodhydrique HI et l'acide perchlorique HClO4 concentrés[10]. Le plutonium fondu doit être maintenu sous vide ou sous atmosphère inerte afin d'éviter la réaction avec l'air[10]. À 135 °C, le plutonium métallique s'enflamme à l'air libre, et explose en présence de tétrachlorométhane[40] CCl4.
Le plutonium réagit avec le carbone pour former des carbures de plutonium Pu3C2, PuC1-δ, Pu2C3 et PuC2 ; il réagit avec l'azote N2 pour former un nitrure PuN, et avec le silicium pour former un siliciure PuSi2[35],[40] ; il réagit avec les halogènes X2, où X peut représenter de fluor, le chlore, le brome et l'iode, en donnant des trihalogénures PuX3. Avec le fluor, outre le trifluorure de plutonium PuF3, on observe également du tétrafluorure de plutonium PuF4 ainsi que de l'hexafluorure de plutonium PuF6. Il se forme par ailleurs des oxyhalogénures PuOCl, PuOBr et PuOI.
Les creusets utilisés avec du plutonium doivent être en mesure de supporter les propriétés très réductrices de ce métal. Les métaux réfractaires, tels que le tantale et le tungstène, ainsi que les oxydes, borures, carbures, nitrures et siliciures les plus stables, peuvent convenir. La fusion dans un four à arc électrique peut permettre de produire de petits lingots de plutonium métallique sans avoir besoin d'un creuset[10].
Corrosion
[modifier | modifier le code]
Le plutonium pur exposé à l'humidité, que ce soit dans l'air ou dans l'argon, se recouvre en quelques minutes d'une couche terne constituée d'un mélange d'oxydes et d'hydrures[26], qui se désagrège en formant une fine poussière volatile dont l'inhalation peut constituer un risque sanitaire sérieux. C'est la raison pour laquelle le plutonium est manipulé dans des boîtes à gants qui préviennent la dispersion atmosphérique de ces poussières.
Plus précisément, le plutonium exposé à l'air sec se recouvre d'une couche de dioxyde de plutonium PuO2 qui assure une passivation remarquable du métal, réduisant la progression de l'oxydation dans le matériau à une valeur aussi faible que 20 pm/h[41]. En revanche, la présence d'humidité introduit des hydrures PuHx, avec 1,9 < x < 3, qui catalysent la corrosion par l'oxygène O2, tandis que l'humidité en l'absence d'oxygène introduit des oxydes intermédiaires comme le sesquioxyde Pu2O3 qui favorisent la corrosion par l'hydrogène. Enfin, l'humidité en présence d'oxygène conduit à l'oxydation du dioxyde PuO2 pour former un oxyde supérieur PuO2+x sur la couche de dioxyde qui semble favoriser la corrosion du métal dans l'air humide[41].
Les poudres de plutonium, de ses hydrures et de certains oxydes tels que Pu2O3 sont pyrophoriques, c'est-à-dire qu'elles peuvent prendre feu spontanément au contact de l'air à température ambiante, et sont par conséquent manipulées sous atmosphère sèche inerte d'azote N2 ou d'argon Ar. Le plutonium massif ne s'enflamme qu'au-dessus de 400 °C. Le Pu2O3 s'échauffe spontanément et se transforme en dioxyde de plutonium PuO2, qui est stable dans l'air sec, mais réagit à chaud avec la vapeur d'eau[42]. Les réactions en jeu seraient ainsi :
Le plutonium réagit également avec l'hydrogène H2 pour former des hydrures PuHx, avec 1,9 < x < 3 :
- 2 Pu + x H2 ⟶ 2 PuHx.
La valeur de x dépend de la pression partielle d'hydrogène et de la température de réaction. Ces hydrures, qui sont solides cristallisés dans le système cubique à faces centrées, sont rapidement oxydés par l'air, et se dissocient en leurs éléments constituants lorsqu'ils sont chauffés sous vide dynamique, c'est-à-dire avec pompage continu de l'hydrogène libéré.
Sûreté
[modifier | modifier le code]Différents types de risques sont à considérer s'agissant de la manipulation du plutonium, qui dépendent étroitement des isotopes en jeu. Les accidents de criticité surviennent lors d'erreurs de manipulation conduisant à la formation d'une masse critique de plutonium et sont susceptibles de provoquer un syndrome d'irradiation aiguë. La radiotoxicité et la reprotoxicité se manifestent à la suite de l'absorption de plutonium dans l'organisme conduisant à l'irradiation des tissus avec des rayonnements ionisants pouvant provoquer des mutations génétiques et induire des cancers.
Les isotopes du plutonium les plus courants sont avant tout des émetteurs α, irradiant des particules α de 4,9 à 5,5 MeV qui sont facilement arrêtées par toute substance solide, notamment l'épiderme. Le plutonium 241 émet des rayons β, plus pénétrants que les rayons α, mais d'à peine 5,2 keV.
D'un point de vue chimique, le plutonium est combustible et pyrophorique, de sorte qu'il présente un risque d'incendie. Sa toxicité chimique, en revanche, n'est pas particulièrement significative.
Criticité
[modifier | modifier le code]L'accumulation de plutonium dans un volume approchant de la masse critique est susceptible de conduire au déclenchement d'une réaction nucléaire émettant une quantité létale de neutrons et de rayons γ[10]. Le risque est d'autant plus grand avec le plutonium que la masse critique du plutonium 239 n'est généralement que le tiers de celle de l'uranium 235[15]. Ce risque est accru en solution en raison de l'effet modérateur de l'hydrogène de l'eau, qui thermalise les neutrons[35].
Plusieurs accidents de criticité impliquant du plutonium ont été rapportés au XXe siècle, certains ayant entraîné la mort de personnes touchées. Ce fut par exemple le cas au laboratoire national de Los Alamos le 21 août 1945 lors d'une erreur de manipulation de briques en carbure de tungstène utilisées comme réflecteurs de neutrons autour d'une sphère en plutonium de qualité militaire, ce qui causa 25 jours plus tard la mort d'Harry Daghlian Jr., alors chercheur du projet Manhattan, à la suite d'un syndrome d'irradiation aiguë consécutif à la dose qu'il a reçue, estimée à 5,1 Sv[43],[44]. Neuf mois plus tard, Louis Slotin mourut également à Los Alamos d'un accident semblable en manipulant des réflecteurs en béryllium autour de la même sphère en plutonium, appelée demon core[45]. Toujours à Los Alamos, un accident différent est survenu en , coûtant la vie à un laborantin, nommé Cecil Kelley, lors d'une opération de purification du plutonium, à la suite de la formation d'une masse critique dans un récipient de mélange. D'autres accidents de ce type se sont produits à travers le monde, que ce soit aux États-Unis, en Union soviétique, au Japon ou dans d'autres pays[46].
Radiotoxicité
[modifier | modifier le code]Élément synthétique produit spécifiquement pour sa radioactivité, le plutonium est surtout connu pour sa radiotoxicité. Celle-ci résulte de trois types de rayonnements ionisants : les rayons α (particules α), les rayons β (électrons) et les rayons γ (photons énergétiques). L'exposition aiguë ou prolongée à ces rayonnements présente des risques pour la santé, susceptibles de se manifester dans le cadre d'un syndrome d'irradiation aiguë, avec mutations génétiques et cancers. Les risques croissent avec la dose absorbée, mesurée en grays (Gy), et plus précisément en fonction de la dose équivalente, mesurée en sieverts (Sv), qui pondère l'impact physiologique des différents types de rayonnements reçus en fonction de leur capacité à causer des dommages dans les tissus irradiés. Cette pondération est introduite par le facteur de dose, mesuré typiquement en microsieverts par becquerel (µSv/Bq) :
Isotope Plutonium 238 Plutonium 239 Plutonium 240 Plutonium 241 Plutonium 242 Activité massique[47] ~630 GBq/g ~2,3 GBq/g ~8,5 GBq/g ~3 700 GBq/g ~0,15 GBq/g Facteur de dose[48] 0,23 µSv/Bq 0,25 µSv/Bq 0,25 µSv/Bq 0,004 8 µSv/Bq 0,24 µSv/Bq
Ainsi, les rayons γ traversent tous les tissus et touchent l'ensemble de l'organisme, tandis que les rayons β sont moins pénétrants et que les rayons α ne franchissent pas l'épiderme mais sont bien plus énergétiques (quelques mégaélectron-volts, contre quelques kiloélectron-volts pour les rayons β et γ). Ainsi, les particules α sont dangereuses lorsqu'elles sont émises au sein même des tissus par le plutonium absorbé[40]. Le principal risque est l'inhalation de particules contenant du plutonium, notamment sous forme de dioxyde de plutonium PuO2, qui se forme rapidement au contact de l'air et qui tend à se désagréger en fines poussières en présence d'humidité. On a ainsi montré une incidence accrue de fibrose pulmonaire[49],[50] et de cancer du poumon chez des salariés du secteur nucléaire[51]. Le risque de cancer du poumon croît lorsque la dose équivalente de plutonium inhalé atteint 400 mSv[52]. En revanche, l'ingestion ne permet d'absorber que 0,04 % du PuO2 ingéré[40]. Les risques concernent également les os, où le plutonium s'accumule, ainsi que le foie, où il est concentré[10].
Tous les isotopes du plutonium ne présentent pas le même niveau de radiotoxicité. Le plutonium de qualité militaire, constitué à plus de 92 % de plutonium 239, présente ainsi une radiotoxicité plutôt modérée[53], en raison de son activité massique plus faible que celle du plutonium 240 et surtout du plutonium 238. Le plutonium 241 a une activité un millier de fois plus élevée, émettant des rayons β qui sont plus pénétrants que le rayonnement α, bien qu'un millier de fois moins énergétiques.
Énergie par mode de désintégration[47] Isotope Plutonium 238 Plutonium 239 Plutonium 240 Plutonium 241 Plutonium 242 Rayonnement α 5,5 MeV 5,1 MeV 5,2 MeV < 1 keV 4,9 MeV Rayonnement β 11 keV 6,7 keV 11 keV 5,2 keV 8,7 keV Rayonnement γ 1,8 keV < 1 keV 1,7 keV < 1 keV 1,4 keV
Le plutonium 238 présente la plus forte radiotoxicité, tandis que le plutonium 241, dont la concentration dans le plutonium croît avec le temps, produit rapidement de l'américium 241, qui émet des rayons γ énergétiques susceptibles d'exposer l'environnement à une irradiation significative[54].
La dose mortelle par syndrome d'irradiation aiguë constatée sur les expérimentations in vivo est de l'ordre de 400 à 4 000 µg/kg en une seule prise, une contamination chronique ayant des effets plus diffus[55]. On estime de ce fait qu'une quantité de l'ordre d'une dizaine de milligrammes provoque le décès d'une personne ayant inhalé en une seule fois des oxydes de plutonium. En effet, les tests effectués sur des babouins et des chiens conduisent à estimer pour l'homme une mortalité de 50 % au bout de 30 jours avec 9 mg, au bout d'un an avec 0,9 mg et 1 000 jours avec 0,4 mg[56].
L'apparition de fibroses et de tumeurs pulmonaires a été mise en évidence chez le chien et le rat après inhalation de composés peu solubles tels que les oxydes de plutonium : la relation dose-effet mise en évidence comporte un seuil d'apparition des tumeurs pour une dose au poumon autour de 1 Gy[56],[57]. Ce seuil d'apparition des tumeurs correspondrait chez l'homme à un dépôt pulmonaire d'environ 200 kBq, soit 87 µg) de 239PuO2[56].
Inflammabilité
[modifier | modifier le code]Le plutonium présente un risque d'incendie, particulièrement lorsqu'il est sous forme de poudre finement divisée. En présence d'humidité, il forme à sa surface des hydrures qui sont pyrophoriques et sont susceptibles de prendre feu à température ambiante. Le risque est réel, et s'est matérialisé en 1969 par un important feu de plutonium au laboratoire national de Rocky Flats[58]. L'accroissement de volume résultant de l'oxydation du plutonium peut atteindre 70 % et briser les récipients de confinement[42]. La radioactivité de ce métal combustible constitue un risque supplémentaire.
L'oxyde de magnésium MgO est sans doute la substance la plus efficace pour éteindre un feu de plutonium : il refroidit le métal en agissant comme dissipateur thermique tout en coupant l'alimentation en oxygène de la combustion. Afin de prévenir les risques d'incendie, il est recommandé de manipuler le plutonium sous atmosphère sèche inerte[42].
Toxicologie
[modifier | modifier le code]Le plutonium présente la toxicité d'un métal lourd au même titre que l'uranium, par exemple, mais elle est moins documentée que celle de ce dernier, et les études ne placent pas la toxicité chimique comme risque majeur associé au plutonium[59],[60]. Plusieurs populations exposées à des poussières de plutonium ont été suivies de près afin d'évaluer l'impact sur leur santé de leur contamination au plutonium[61], comme les personnes résidant à proximité de sites d'expérimentation nucléaires atmosphériques lorsqu'ils étaient autorisés, les personnes travaillant dans des installations nucléaires, les rescapés du bombardement atomique de Nagasaki, voire des patients « en phase terminale » de maladies mortelles à qui a été injecté du plutonium dans les années 1945-1946 pour en observer la métabolisation dans le corps humain. Ces études ne montrent généralement pas de toxicité particulièrement élevée pour le plutonium, avec des exemples de cas célèbres comme celui d'Albert Stevens, cité par Bernard Cohen (en)[60], qui vécut jusqu'à un âge avancé après avoir subi des injections de plutonium. Plusieurs dizaines de chercheurs du laboratoire national de Los Alamos ont également inhalé des quantités significatives de poussières de plutonium dans les années 1940 sans développer de cancer du poumon[62].
Certains discours antinucléaires[63],[64],[65],[66],[67],[68] affirment que « l'ingestion d'un seul millionième de gramme est fatale », ce qui n'est pas étayé par la documentation existante[69]. Les données épidémiologiques des membres du « club des UPPU[d] », c'est-à-dire des 26 personnes ayant travaillé au laboratoire national de Los Alamos sur du plutonium et en ayant ingéré au point qu'il était suivi dans les urines, montrent par exemple une mortalité et un taux de cancers inférieurs à la moyenne[70].
L'affirmation selon laquelle « Il suffirait de quelques centaines de grammes de plutonium répandue uniformément sur terre, pour y effacer toute forme de vie humaine »[68] n'est pas non plus conforme aux données disponibles. On estime en effet que la dispersion d'une masse de l'ordre du kilogramme sur une surface de quelques centaines de kilomètres carrés (soit dans un rayon d'environ 10 km) conduit à une contamination inférieure au centième de microgramme par mètre carré[67],[71], de sorte quelques centaines de grammes répartis uniformément à la surface de la Terre seraient bien en deçà de toute quantité détectable.
Il convient également de distinguer la radiotoxicité du plutonium 238, qui est particulièrement élevée, de celle du plutonium 239 employé par l'armée et l'industrie nucléaire, dont la radioactivité spontanée est sensiblement moindre. Ces deux isotopes sont produits en quantités très différentes, par des circuits distincts et pour des usages qui n'ont aucun rapport : le plutonium 238 est produit à raison de quelques kilogrammes essentiellement comme source d'énergie embarquée pour générateur thermoélectrique à radioisotope, tandis que le plutonium 239 est produit à raison de plusieurs tonnes pour tirer profit de sa nature d'isotope fissile dans des réacteurs nucléaires ou des armes nucléaires[72].
Toxicodynamique
[modifier | modifier le code]Chez l'homme, le plutonium absorbé est transporté par des transferrines[73],[74],[75],[76] et est stocké dans le sang par la ferritine[77],[78],[79],[80] pour finir par s'accumuler essentiellement dans les os, également dans le foie, et, dans une moindre mesure, dans les poumons[81]. Il demeure dans le corps humain avec une demi-vie biologique d'environ 50 ans[82]. Un moyen courant d'en limiter les effets est d'injecter un complexe d'acide diéthylène-triamine penta-acétique[83],[84],[85] (DTPA, parfois appelé « acide pentétique ») avec du calcium[86] ou du zinc[87] dans les 24 h suivant la contamination, ce qui limite la fixation du plutonium, ainsi que de l'américium et du curium. D'autres chélateurs peuvent également être utilisés, comme l'entérobactine[88] et la déféroxamine, certains avec une meilleure efficacité que le DTPA, comme le 3,4,3-LIHOPO ou la DFO-HOPO[89] (déféroxamine-hydroxypyridinone).
On estime que chez l'Homme, 10 % du plutonium qui a franchi la barrière intestinale ou pulmonaire quitte le corps (via l'urine, et les excréments). Le reste après passage dans le sang se fixe pour moitié dans le foie et pour moitié dans le squelette, où il demeure très longtemps et pour partie à vie (Le DOE américain estime que la demi-vie dans l'organe est respectivement de 20 et 50 ans pour le foie et l'os, selon des modèles simplifiés ne tenant pas compte de redistributions intermédiaires (en cas de fracture et/ou de ménopause (cf. décalcification) et lors du recyclage normal de l'os, etc). Le DOE précise que le taux accumulé dans le foie et le squelette dépend aussi de l'âge de l'individu (l'absorption dans le foie augmente avec l'âge), et qu'en fait, le plutonium se fixe d'abord sur la surface corticale et trabéculaire des os avant d'être lentement redistribué dans tout le volume minéral osseux.
Applications
[modifier | modifier le code]Militaires
[modifier | modifier le code]Le plutonium 239 est un isotope fissile clé pour la réalisation d'armes nucléaires en raison de sa relative facilité de mise en œuvre et de sa disponibilité assez élevée. Il est possible de réduire la masse critique nécessaire à l'explosion en entourant le cœur de plutonium par des réflecteurs de neutrons qui ont le double rôle d'augmenter le flux de neutrons thermiques dans le cœur et de retarder l'expansion thermique de ce dernier afin d'y prolonger la réaction en chaîne et d'accroître la puissance de l'explosion nucléaire.
Une masse de 10 kg de plutonium 239 sans réflecteur suffit généralement pour atteindre la criticité[90] ; cette masse peut être divisée par deux par une conception optimisée. C'est environ le tiers de la masse critique de l'uranium 235.
La bombe Fat Man larguée sur Nagasaki par les États-Unis le 9 août 1945 utilisait une charge de 6,4 kg d'alliage plutonium-gallium 239Pu-240Pu-Ga 96:1:3 autour d'une source de neutrons d'amorçage Be-210Po le tout cerné de lentilles explosives comprimant le plutonium pour en accroître significativement la masse volumique et donc la puissance de l'explosion, qui atteignit l'équivalent de 20 000 t de TNT[91]. Il est en théorie possible de réduire la masse de plutonium nécessaire dans une arme nucléaire pour atteindre la criticité à moins de 4 kg moyennant une conception suffisamment élaborée.
Civiles
[modifier | modifier le code]Le combustible nucléaire usagé provenant de réacteurs à eau légère conventionnels contient un mélange d'isotopes 238Pu, 239Pu, 240Pu et 242Pu. Ce mélange n'est pas suffisamment enrichi en plutonium 239 pour permettre la réalisation d'armes nucléaires mais peut être recyclé en combustible MOX. Les captures neutroniques accidentelles au cours de la réaction nucléaire accroissent la quantité de plutonium 240 et de plutonium 242 chaque fois que le plutonium est irradié dans un réacteur à neutrons thermiques de sorte que, à l'issue d'un premier cycle, le plutonium ne peut plus être utilisé que par des réacteurs à neutrons rapides. Si de tels réacteurs ne sont pas disponibles, ce qui est généralement le cas, le plutonium en excès est généralement éliminé en formant des déchets radioactifs à vie longue. La volonté de réduire la quantité de tels déchets et de les valoriser a poussé à réaliser davantage de réacteurs à neutrons rapides[92].
Le procédé chimique le plus courant, dit PUREX, permet le retraitement du combustible nucléaire usé en extrayant le plutonium et l'uranium qu'il contient afin de former un mélange d'oxydes dit MOX, essentiellement du dioxyde d'uranium UO2 et du dioxyde de plutonium PuO2, pouvant être utilisé à nouveau dans des réacteurs nucléaires. Du plutonium de qualité militaire peut être ajouté à ce mélange pour en accroître les performances énergétiques. Le MOX peut être utilisé dans les réacteurs à eau légère et contient environ 60 kg par tonne de combustible ; après quatre années d'utilisation, les trois quarts du plutonium sont consommés. Les surgénérateurs sont conçus afin d'optimiser l'utilisation des neutrons produits au cours de la réaction nucléaire en les utilisant pour produire, à partir d'atomes fertiles, davantage de matériau fissile qu'ils en consomment[92].
Le MOX est utilisé depuis les années 1980, notamment en Europe. Les États-Unis et la Russie ont signé, en , l'Accord de gestion et de traitement du plutonium (PMDA) par lequel ils entendent éliminer 34 tonnes de plutonium de qualité militaire ; le DOE américain prévoit d'avoir recyclé cette masse de plutonium en MOX avant la fin de l'année 2019[93].
Le MOX accroît le rendement énergétique total. Une barre de combustible nucléaire est retraitée après une utilisation de trois ans afin d'en extraire les déchets, qui représentent alors environ 3 % de la masse totale de ces barres[40]. Les isotopes d'uranium et de plutonium produits au cours de ces trois années d'exploitation[e] sont laissés dans la barre de combustible, qui retourne dans un réacteur pour y être utilisé. La présence de gallium jusqu'à hauteur de 1 % pondéral dans le plutonium de qualité militaire peut interférer avec l'utilisation à long terme de ce matériau dans un réacteur à eau légère[94].
Les plus grandes installations déclarées de recyclage du plutonium sont les unités B205 (en) et THORP (en)[f] de Sellafield, au Royaume-Uni ; l'usine de retraitement de la Hague, en France ; l'usine nucléaire de Rokkasho, au Japon ; et le complexe nucléaire Maïak en Russie ; il existe d'autres sites déclarés plus modestes, par exemple en Inde et au Pakistan.
Spatiales
[modifier | modifier le code]Le plutonium 238 a une demi-vie de 87,74 ans. Il émet une grande quantité d'énergie thermique accompagnée de faibles flux de neutrons et de photons d'énergie gamma. Un kilogramme de cet isotope peut dégager une puissance thermique d'environ 570 W. Il émet principalement des particules α d'énergie élevée mais qui sont faiblement pénétrantes, de sorte qu'il ne nécessite qu'un blindage léger. Une feuille de papier suffit pour arrêter des rayons α[96].
Ces caractéristiques font de cet isotope du plutonium une source thermique particulièrement intéressante pour les applications embarquées devant fonctionner sans possibilité de maintenance directe pendant la durée d'une vie humaine. Il a par conséquent été utilisé comme source de chaleur dans les générateurs thermiques à radioisotope (RTG) et éléments chauffants à radioisotope (RHU) comme ceux des sondes Cassini-Huygens[97], Voyager, Galileo et New Horizons, ainsi que le rover Curiosity de Mars Science Laboratory.
Les sondes jumelles Voyager ont été lancées en 1977, chacune avec une source en plutonium libérant une puissance de 500 W. Plus de 30 ans plus tard, ces sources d'énergie libéraient encore une puissance de 300 W permettant un fonctionnement limité des sondes[98]. Une version plus ancienne de cette technologie alimentait les cinq Apollo Lunar Surface Experiments Packages à partir d'Apollo 12 en 1969[40].
Le plutonium 238 a également été utilisé avec succès pour alimenter des stimulateurs cardiaques afin d'éviter les interventions chirurgicales répétées pour remplacer la source d'énergie[99]. Le plutonium 238 a depuis été largement remplacé dans cet usage par les piles au lithium, mais il restait encore en 2003 entre 50 et 100 patients aux États-Unis équipés de stimulateurs cardiaques alimentés au plutonium 238[100].
Sécurité
[modifier | modifier le code]Le plutonium étant susceptible d'être utilisé à des fins militaires ou terroristes, il fait l'objet de nombreux textes et conventions internationaux visant à en prévenir la prolifération. Le plutonium recyclé à partir de combustible nucléaire usé présente un risque de prolifération limité en raison de sa contamination élevée en isotopes non fissiles tels que le plutonium 240 et le plutonium 242, dont l'élimination n'est pas réalisable.
Un réacteur opérant avec un taux de combustion très faible produit peu de ces isotopes indésirables et laisse donc un matériau nucléaire potentiellement utilisable à des fins militaires. Le plutonium de qualité militaire est censé être constitué au moins de 92 % de plutonium 239, mais il est techniquement possible de faire exploser une bombe nucléaire de faible puissance à partir de plutonium ne contenant que 85 % de plutonium 239[g]. Le plutonium produit par un réacteur à eau légère avec un taux de combustion normal contient généralement moins de 60 % de plutonium 239, 10 % de plutonium 241 fissile et jusqu'à 30 % d'isotopes indésirables plutonium 240 et 242. On ignore s'il est possible de faire exploser un engin nucléaire constitué d'un tel matériau, cependant un tel engin pourrait probablement répandre de la matière radioactive sur une surface étendue.
L'Agence internationale de l'énergie atomique classifie ainsi tous les isotopes du plutonium, qu'ils soient fissiles ou non, comme matériau directement utilisable à des fins nucléaires, c'est-à-dire comme matériau nucléaire qui peut être utilisé pour la fabrication d'explosifs nucléaires sans transmutation ni enrichissement supplémentaire. En France, le plutonium est une matière nucléaire dont la détention est réglementée par le chapitre III du code de la Défense[102].
Origine
[modifier | modifier le code]Le plutonium est un élément chimique qui est des plus rares dans la nature et presque exclusivement produit par l'homme de 1940 à nos jours. Cependant, de 4 à 30 kg de plutonium 239 seraient produits chaque année sur Terre par radioactivité α de l'uranium sur des éléments plus légers ainsi que sous l'effet des rayons cosmiques[103]. C'est le deuxième des transuraniens à avoir été découvert.
L'isotope 238Pu a été produit en 1940 en bombardant une cible d'uranium par du deutérium au cyclotron de Berkeley[104]. Durant le projet Manhattan, le plutonium 239 avait le nom de code 49, le '4' étant le dernier chiffre de 94 (le numéro atomique) et le '9', le dernier chiffre de 239, la masse atomique de l'isotope utilisé pour la bombe, le 239Pu[105].
Il n'y a plus de plutonium en quantités détectables remontant à une nucléosynthèse primordiale. Des publications anciennes font toutefois état d'observations de plutonium 244 naturel[106]. On trouve par ailleurs des traces de plutonium 239 dans les minerais d'uranium naturel (de même que du neptunium), où il résulte de l'irradiation de l'uranium par le très faible taux de neutrons créés par la désintégration spontanée de l'uranium.
Il a été produit plus massivement (et existe encore en quantités infimes) sous forme de 239Pu dans des structures géologiques particulières, où de l'uranium a été naturellement concentré par des processus géologiques il y a environ 2 milliards d'années, pour atteindre une criticité suffisante pour engendrer une réaction nucléaire naturelle. Son taux de formation dans le minerai d'uranium a ainsi été accéléré par des réactions nucléaires rendues possibles par un accident de criticité naturel. C'est le cas sur le site du réacteur nucléaire naturel d'Oklo.
Production
[modifier | modifier le code]Plutonium 238
[modifier | modifier le code]
Dans les centrales nucléaires, du plutonium 238 est formé parallèlement au plutonium 239, par la chaîne de transformation commençant par l'uranium 235 fissible.
- L'uranium 235 qui capture un neutron thermique peut se stabiliser par émission d'un rayonnement γ dans 16 % des cas. Il forme alors un atome 236U, relativement stable (demi-vie de 23 millions d'années).
- Une deuxième capture neutronique le transforme en 237U (pour mémoire, des noyaux 238U peuvent également subir une réaction (n, 2n) qui les transforme en 237U par perte d'un neutron). L'uranium 237 est instable avec une demi-vie de 6,75 jours, et se transforme par émission β− en neptunium 237, relativement stable (demi-vie de 2,2 millions d'années).
- Une troisième capture neutronique transforme le noyau en neptunium 238, instable de demi-vie 2,1 jours, qui se transforme en plutonium 238 par émission β−.
Le plutonium 238, d'une demi-vie de 86,41 ans, est un émetteur très puissant de rayonnement α. En raison de son activité massique α et γ élevée, il est utilisé comme source de neutrons (par « réaction α » avec des éléments légers), comme source de chaleur et comme source d'énergie électrique (générateurs thermoélectriques à radiositopes). Les utilisations du 238Pu pour produire de l'électricité sont cantonnées aux utilisations spatiales, et, par le passé, à certains stimulateurs cardiaques.
On prépare le plutonium 238 à partir de l'irradiation neutronique du neptunium 237, un actinide mineur récupéré pendant le retraitement, ou à partir de l'irradiation de l'américium, en réacteur. Dans les deux cas, pour extraire le plutonium 238 des cibles, on les soumet à un traitement chimique, comportant une dissolution nitrique.
Il n'y a qu'environ 700 g/t de neptunium 237 dans le combustible des réacteurs à eau ordinaire irradié pendant 3 ans, et il faut l'extraire sélectivement.
Plutonium 239
[modifier | modifier le code]L'irradiation de l'uranium 238 dans les réacteurs nucléaires génère du plutonium 239 par capture de neutrons. Dans un premier temps, un atome d'uranium 238 capture un neutron et se transforme transitoirement en uranium 239. Cette réaction de capture est plus facile avec des neutrons rapides qu'avec des neutrons thermiques, mais est présente dans les deux cas.
L'uranium 239 formé est fortement instable. Il se transforme rapidement (avec une demi-vie de 23,5 minutes) en neptunium par radioactivité β− :
Le neptunium 239 est également instable, et subit à son tour une décroissance β− (avec une demi-vie de 2,36 jours) qui le transforme en plutonium 239 relativement stable (demi-vie de 24 000 ans).
Le plutonium 239 est fissile, et il peut donc contribuer à la réaction en chaine du réacteur. De ce fait, pour le bilan énergétique d'un réacteur nucléaire, le potentiel énergétique de l'uranium présent dans le réacteur comprend non seulement celui de l'uranium 235 initialement présent, mais également celui de l'uranium 238 fertile qui aura été transmuté en plutonium.
Soumis à un flux neutronique en réacteur, le plutonium 239 peut également capturer un neutron sans subir de fission. Quand le combustible subit des périodes d'irradiation de plus en plus longues, les isotopes supérieurs s'accumulent de cette manière, en raison de l'absorption de neutrons par le plutonium 239 et ses produits. Il se forme ainsi des isotopes 240Pu, 241Pu, 242Pu, jusqu'au 243Pu instable qui se désintègre en américium 243.
L'isotope intéressant par son caractère fissile est le 239Pu, relativement stable à échelle humaine (24 000 ans).
Le rythme de production d'un isotope dépend de la disponibilité de son précurseur, qui doit avoir eu le temps de s'accumuler. Dans un combustible neuf, le 239Pu se forme donc linéairement en fonction du temps, la proportion de 240Pu augmente suivant une loi au carré du temps (en t2), celle de 241Pu suivant une loi au cube du temps (en t3), et ainsi de suite.
Ainsi, quand on utilise un réacteur spécifique pour la fabrication du « plutonium militaire », le combustible utilisé pour la production du plutonium aussi bien que les cibles et la couverture s'il y en a, sont extraits après un bref séjour (quelques semaines) dans le réacteur afin d'avoir l'assurance que le plutonium 239 est aussi pur que possible. En revanche, pour des usages civils, une brève irradiation n'extrait pas toute l'énergie que le combustible peut produire. On n'enlève donc le combustible des réacteurs électrogènes qu'après un séjour beaucoup plus long (3 ou 4 ans).
En première approximation, un réacteur produit typiquement 0,8 atome de 239Pu pour chaque fission de 235U, soit un gramme de plutonium par jour et par MW de puissance thermique (les réacteurs à eau légère produisant moins que les graphite-gaz). Ainsi, en France, les réacteurs nucléaires produisent chaque année environ 11 tonnes de plutonium[107].
Plutonium 240
[modifier | modifier le code]Le 240Pu est simplement fertile et présente une radioactivité « seulement » quatre fois plus élevée que le 239Pu (avec une demi-vie de 6 500 ans).
Plutonium 241
[modifier | modifier le code]Le 241Pu est également fissile, mais extrêmement radioactif (demi-vie de 14,29 ans).
En outre il se désintègre en produisant de l'américium 241 neutrophage, qui réduit par son accumulation éventuelle l'efficacité des dispositifs nucléaires militaires ou civils.
Plutonium 242
[modifier | modifier le code]Le 242Pu a une durée de vie beaucoup plus longue que les précédents (373 000 ans). Il n'est pas fissile en neutrons thermiques. Sa section efficace est beaucoup plus faible que celle des autres isotopes ; le recyclage successif du plutonium en réacteur tend donc à accumuler le plutonium sous cette forme très peu fertile.
Plutonium 243
[modifier | modifier le code]Le 243Pu est instable (demi-vie de moins de 5 heures) et se désintègre en américium 243.
Plutonium 244
[modifier | modifier le code]Le plutonium 244, l'isotope le plus stable d'une demi-vie de 80 millions d'années, ne se forme pas dans les réacteurs nucléaires. En effet, les captures neutroniques successives partant de l'uranium 239 conduisent au 243Pu, de très faible demi-vie (de l'ordre de cinq heures). Même dans des réacteurs « à haut flux », le 243Pu se transforme rapidement en 243Am, sans avoir le temps de capturer un neutron supplémentaire pour former le 244Pu.
En revanche, des flux neutroniques plus importants permettent cette formation. Il est synthétisé lors des explosions nucléaires ou par nucléosynthèse stellaire lors de l'explosion d'une supernova. Ainsi, en 1952, l'explosion de la première bombe thermonucléaire américaine (test Ivy Mike) a ainsi produit deux radioisotopes alors encore inconnus : le plutonium 244 (244Pu) et le plutonium 246 (246Pu). Les traces de 244Pu dans l'environnement sont généralement attribuées aux essais nucléaires atmosphériques ainsi qu'à des reliquats de 244Pu primordial.
Stocks mondiaux
[modifier | modifier le code]Après près de 70 ans d'une production mondiale toujours croissante, les stocks déclarés de plutonium atteignent un total de 500 tonnes à la fin de l'année 2013, dont 52 % d'origine civile et 48 % militaire[108]. Les stocks déclarés sont essentiellement répartis entre 5 pays :
- Russie : 178 tonnes soit 35,6 %
- Royaume-Uni : 107,2 tonnes soit 21,4 %
- États-Unis : 88,3 tonnes soit 17,7 %
- France : 66,2 tonnes soit 13,2 %
- Japon : 47,1 tonnes soit 9,4 %
- Reste du monde : 13 tonnes soit 3 %
Notes
[modifier | modifier le code]- ↑ À la température de transition de phase.
- ↑ Masse volumique correspondante donnée à 0 °C.
- ↑ L'ion PuO2+ est instable en solution et se dismute en Pu4+ et PuO22+ ; le Pu4+ oxyde alors le PuO2+ résiduel en PuO22+ en devenant lui-même du Pu3+. Une solution de PuO2+ devient donc au fil du temps un mélange de PuO22+ et de Pu3+. L'ion UO2+ est instable pour la même raison[36].
- ↑ En anglais, UPPU se lit you pee Pu, c'est-à-dire « tu pisses du plutonium ».
- ↑ La composition isotopique du plutonium dans un combustible nucléaire usagé est de l'ordre de 58 % de 239Pu, 24 % de 240Pu, 11 % de 241Pu, 5 % de 242Pu et 2 % de 238Pu[40].
- ↑ Une fuite importante de plutonium et d'uranium est survenue le 19 avril 2005 à l'usine THORP (en) à la suite d'une rupture de soudure dans une des cuves de retraitement. 200 kg de plutonium ont été perdus avec 83 000 L de matière radioactive provenant d'une cuve en béton armé conçue pour recueillir d'éventuelles pertes. Cette fuite a fait suite à une rupture de canalisation qui n'avait pas été détectée, les techniciens ayant ignoré, durant plusieurs mois, les indicateurs d'alerte à ce sujet, qui signalaient une perte de masse dans la cuve signifiant une fuite. Craignant un accident de criticité, l'autorité de sûreté a provisoirement fermé l'une des deux installations jumelles[95].
- ↑ Les États-Unis ont ainsi fait exploser un engin nucléaire en 1962 à partir de combustible usé provenant d'un réacteur britannique Magnox, très probablement celui de la centrale nucléaire de Chapelcross, de type Calder Hall ; la composition isotopique de ce plutonium n'a pas été rendue publique mais n'excède certainement pas 85 % de plutonium 239[101].
Notes et références
[modifier | modifier le code]- ↑ (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j)
- ↑ (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203
- ↑ (en) John W. Arblaster, Selected Values of the Crystallographic Properties of Elements, ASM International, 2018 (ISBN 978-1-62708-155-9).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0)
- ↑ (en) David L. Clark, Gordon Jarvinen, Cynthia Kowalczyk, Jim Rubin et Mary Ann Stroud, « Nitric Acid Processing » [PDF], Actinide Research Quarterly — 3rd Quarter 2008, sur Actinide Research Quarterly (ARQ) sur le site du Los Alamos National Laboratory, Seaborg Institute for Transactinium Science, (consulté le ), p. 10.
- ↑
(en) David L. Clark, Gordon Jarvinen, Cynthia Kowalczyk, Jim Rubin et Mary Ann Stroud, « Nitric Acid Processing » [PDF], Actinide Research Quarterly — 3rd Quarter 2008, sur Actinide Research Quarterly (ARQ) sur le site du Los Alamos National Laboratory, Seaborg Institute for Transactinium Science, (consulté le ), p. 6 :
.« While plutonium dioxide is normally olive green, samples can be various colors. It is generally believed that the color is a function of chemical purity, stoichiometry, particle size, and method of preparation, although the color resulting from a given preparation method is not always reproducible. »
- (en) A. Michael Boring et James L. Smith, « Plutonium Condensed-Matter Physics – A survey of theory and experiment », Los Alamos Science, no 26, , p. 90-127 (lire en ligne)
- (en) Siegfried S. Hecker, « Plutonium and Its Alloys – From atoms to microstructure », Los Alamos Science, no 26, , p. 290-335 (lire en ligne)
- ↑ (en) Siegfried S. Hecker et Michael F. Stevens, « Mechanical Behavior of Plutonium and Its Alloys », Los Alamos Science, no 26, , p. 336-355 (lire en ligne)
- (en) William N. Miner et Fred W. Schonfeld, « Plutonium », The Encyclopedia of the Chemical Elements, 1968, Clifford A. Hampel, Reinhold Book Corporation, New York, pp. 540–546
- ↑ (en) Siegfried S. Hecker, « Plutonium, an element at odds with itself », Los Alamos Science, no 26, , p. 16-23 (lire en ligne)
- ↑ (en) Siegfried S. Hecker et Joseph C. Martz, « Aging of Plutonium and Its Alloys », Los Alamos Science, no 26, , p. 238-243 (lire en ligne)
- ↑ (en) Dana C. Christensen, « The Future Role of Plutonium Technology », Los Alamos Science, no 23, , p. 168-173 (lire en ligne)
- (en) « Chart of Nuclides »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur National Nuclear Data Center (consulté le ).
- (en) David L. Heiserman, « Element 94: Plutonium », Exploring Chemical Elements and their Compounds, 1992, TAB Books, New York (NY), pp. 337–340. (ISBN 0-8306-3018-X).
- ↑ (en) Isaac Asimov, Nuclear Reactors, Understanding Physics, 1988, Barnes & Noble Publishing, New York. (ISBN 0-88029-251-2).
- ↑ (en) Samuel Glasstone et Leslie M. Redman, « An introduction to nuclear weapons » [PDF], sur web.archive.org, Atomic Energy Commission, (consulté le ).
- ↑ (en) F. G. Gosling, (1999). The Manhattan Project: Making the Atomic Bomb « Copie archivée » (version du sur Internet Archive) [PDF], 1999, United States Department of Energy, Oak Ridge. (ISBN 0-7881-7880-6)
- ↑ (en) « Plutonium: the 50 Years » [PDF], sur web.archive.org, U.S. Department of Energy, (consulté le ).
- ↑ (en) J. W. Kennedy, G. T. Seaborg, E. Segrè et A. C. Wahl, « Properties of 94(239) », Physical Review, vol. 70, nos 7-8, , p. 555-556 (DOI 10.1103/PhysRev.70.555, Bibcode 1946PhRv...70..555K, lire en ligne)
- ↑ (en) Louis A. Turner, « Atomic Energy from U238 », Physical Review, vol. 69, nos 7-8, , p. 366-366 (DOI 10.1103/PhysRev.69.366, Bibcode 1946PhRv...69..366T, lire en ligne)
- ↑ (en) David L. Heiserman, Exploring Chemical Elements and their Compounds, New York (NY), TAB Books, , 1re éd., 376 p. (ISBN 978-0-8306-3018-9, LCCN 91017687), « Element 94: Plutonium », p. 337–340
- ↑ (en) Richard Rhodes, The Making of the Atomic Bomb, New York, Simon & Schuster, , 1re éd., 886 p., poche (ISBN 978-0-671-65719-2, LCCN 86015445), p. 659–660 Leona Marshall : « Quand vous en prenez un lingot en main, on sent qu'il est chaud comme un lapin vivant ».
- ↑ K. Beaugelin-Seiller, D. Boust, P. Germain, S. Roussel-Debet et C. Colle, « Plutonium et environnement » [PDF], Fiche Radionucléide, sur irsn.fr, Institut de radioprotection et de sûreté nucléaire, (consulté le ).
- ↑ (en) « Can Reactor Grade Plutonium Produce Nuclear Fission Weapons? », sur cnfc.or.jp, Council for Nuclear Fuel Cycle Institute for Energy Economics Japan, (consulté le ).
- (en) « Plutonium, Radioactive » [html], National Institutes of Health (consulté le ).
- (en) « Plutonium Crystal Phase Transitions », GlobalSecurity.org.
- ↑ (en) Kenton James Moody, Ian D. Hutcheon et Patrick M. Grant, Nuclear forensic analysis, 2005, CRC Press, p. 169. (ISBN 0-8493-1513-1)
- ↑ (en) David G. Kolman et Lisa P. Colletti, « Aqueous Corrosion Behavior of Plutonium Metal and Plutonium–Gallium Alloys Exposed to Aqueous Nitrate and Chloride Solutions », Journal of the Electrochemical Society, vol. 155, no 12, , C565-C570 (DOI 10.1149/1.2976352, lire en ligne)
- ↑ (en) D. G. Hurst, A. G. Ward, Canadian Research Reactors [PDF], 1956, Atomic Energy of Canada Limited, Ottawa.
- (en) A. E. Kay, Plutonium 1965, 1965, Taylor & Francis.
- ↑ (en) Gerard L. Hofman, R. G. Pahl, C. E. Lahm et D. L. Porter, « Swelling behavior of U-Pu-Zr fuel », Metallurgical Transactions A, vol. 21, no 2, , p. 517-528 (DOI 10.1007/BF02671924, Bibcode 1990MTA....21..517H, lire en ligne)
- ↑ (en) R. G. Pahl, D. L. Porter, C. E. Lahm et G. L. Hofman, « Experimental studies of U-Pu-Zr fast reactor fuel pins in the experimental breeder reactor-ll », Metallurgical Transactions A, vol. 21, no 7, , p. 1863–1870 (DOI 10.1007/BF02647233, Bibcode 1990MTA....21.1863P, lire en ligne)
- ↑ (en) David L. Clark, « The Chemical Complexities of Plutonium », Los Alamos Science, no 26, , p. 364-381 (lire en ligne)
- (en) David R. Lide, Handbook of Chemistry and Physics, 2006, CRC Press, Taylor & Francis Group 87e édition, Boca Raton. (ISBN 0-8493-0487-3)
- ↑ (en) William J. Crooks, « Nuclear Criticality Safety Engineering Training Module 10 – Criticality Safety in Material Processing Operations, Part 1 » [PDF], 2002.
- ↑ (en) Cory J. Windorff, Guo P. Chen, Justin N. Cross, William J. Evans, Filipp Furche, Andrew J. Gaunt, Michael T. Janicke, Stosh A. Kozimor et Brian L. Scott, « Identification of the Formal +2 Oxidation State of Plutonium: Synthesis and Characterization of {PuII[C5H3(SiMe3)2]3}− », Journal of the American Chemical Society, vol. 139, no 11, , p. 3970-3973 (PMID 28235179, DOI 10.1021/jacs.7b00706, lire en ligne)
- ↑ (en) George Matlack, A Plutonium Primer: An Introduction to Plutonium Chemistry and Its Radioactivity, Los Alamos national Laboratory, janvier 2003.
- ↑ (en) Mary Eagleson, Concise Encyclopedia Chemistry, 1994, Walter de Gruyter, Berlin, p. 840. (ISBN 978-3-11-011451-5).
- (en) John Emsley, (2001). « Plutonium », Nature's Building Blocks: An A–Z Guide to the Elements, 2001, Oxford University Press, Oxford (UK). (ISBN 0-19-850340-7).
- (en) John M. Haschke, Thomas H. Allen et Luis A. Morales, « Surface and Corrosion Chemistry of Plutonium », Los Alamos Science, no 26, , p. 252-273 (lire en ligne)
- (en) « Plutonium », Primer on Spontaneous Heating and Pyrophoricity, sur web.archive.org, U.S. Department of Energy, Washington, D.C. 20585, (consulté le ).
- ↑ (en) Kevin N. Roark, « Criticality accidents report issued », laboratoire national de Los Alamos, 8 octobre 2008
- ↑ (en) Jon Hunner, Inventing Los Alamos, 2004 (ISBN 978-0-8061-3891-6).
- ↑ (en) « Raemer Schreiber », Staff Biographies, Los Alamos 16 novembre 2008.
- ↑ (en) William R. Stratton, « A Review of Criticality Accidents » [PDF], Laboratoire national de Los Alamos, (consulté le ).
- (en) John Peterson, Margaret MacDonell, Lynne Haroun et Fred Monette, « Radiological and Chemical Fact Sheets to Support Health Risk Analyses for Contaminated Areas » [PDF], sur Radiation Emergency Medical Management, Argonne National Laboratory Environmental Science Division, (consulté le ).
- ↑ Ch. O. Bacri, « La gestion des déchets nucléaires »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) [PDF], De la physique au détecteur, sur in2p3.fr, IN2P3, (consulté le ), p. 17.
- ↑ Lee S. Newman, Margaret M. Mroz et A. James Ruttenber, « Lung Fibrosis in Plutonium Workers », Radiation Research, vol. 164, no 2, , p. 123–131 (ISSN 0033-7587 et 1938-5404, DOI 10.1667/rr3407, lire en ligne, consulté le )
- ↑ Tamara Azizova, Maria Moseeva, Evgeniya Grigoryeva et Galina Zhuntova, « Registry of Plutonium-induced Lung Fibrosis in a Russian Nuclear Worker Cohort », Health Physics, vol. 118, no 2, , p. 185–192 (ISSN 1538-5159 et 0017-9078, DOI 10.1097/hp.0000000000001131, lire en ligne, consulté le )
- ↑ (en) James Grellier, Will Atkinson, Philippe Bérard, Derek Bingham, Alan Birchall, Eric Blanchardon, Richard Bull, Irina Canu Guseva, Cécile Challeton-de Vathaire, Rupert Cockerill, Minh T. Do, Hilde Engels, Jordi Figuerola, Adrian Foster, Luc Holmstock, Christian Hurtgen, Dominique Laurier, Matthew Puncher, Anthony E. Riddell, Eric Samson, Isabelle Thierry-Chef, Margot Tirmarche, Martine Vrijheid et Elisabeth Cardis, « Risk of lung cancer mortality in nuclear workers from internal exposure to alpha particle-emitting radionuclides », Epidemiology, (DOI 10.1097/EDE.0000000000000684, lire en ligne)
- ↑
- ↑ FAS fact sheet
- ↑ (en) Reuben Rainisch, « Effect of Americium-241 Content on Plutonium Radiation Source Terms » [PDF], American Nuclear Society 1999 Annual Meeting and Embedded Topical at Boston, (consulté le ).
- ↑ (en) William Moss et Roger Eckhardt, « The Human Plutonium Injection Experiments », Los Alamos Science, vol. 23, , p. 177-233 (lire en ligne)
- Guillaume Phan, François Rebière, Jean-Michel Deligne et Jean-René Jourdain, « Plutonium : Aspects sanitaires » [PDF], Fiche radionucléide, sur centredoc.ecole-eme.fr de l'École des métiers de l'environnement (France), IRSN, (consulté le ), p. 5.
- ↑ Fiche radiotoxicologique Plutonium, CEA, décembre 2005.
- ↑ (en) David Albright et Kevin O'Neill, « The Lessons of Nuclear Secrecy at Rocky Flats », sur web.archive.org, Institute for Science and International Security, (consulté le ).
- ↑ (en) Bernard L. Cohen, « Hazards from Plutonium Toxicity », Health Physics, vol. 32, no 5, , p. 359-379 (PMID 881333, DOI 10.1097/00004032-197705000-00003, lire en ligne)
- (en) Bernard L. Cohen, « The Myth of Plutonium Toxicity », sur web.archive.org, (consulté le ).
- ↑ (en) « Toxicological Profile for Plutonium », sur ATSDR Toxic Substances Portal, Agency for Toxic Substances & Disease Registry, (consulté le ).
- ↑ (en) G. L. Voelz, « What We Have Learned about Plutonium from Human Data », Health Physics, vol. 29, no 4, , p. 551-561 (PMID 1205858, DOI 10.1097/00004032-197510000-00011, lire en ligne)
- ↑ radioactivité naturelle et artificielle, l'électron libre, 12/2002
- ↑ Nucléaire : comment en sortir ?, Réseau "Sortir du nucléaire", 2007.
- ↑ La lettre d'information avril 2011, EELV Midi-Pyrénées.
- ↑ Fleur Australe, Géraldine Danon, Flammarion -Arthaud, 2012.
- L’exploration spatiale, "nouvelle frontière" du nucléaire ?, Sortir du nucléaire no 56 - Hiver 2012-2013
- Y'a quéqu' chose qui cloche là-d'dans... , Le blog de Gdalia Roulin, Mediapart, 4 juillet 2015.
- ↑ (en) « Toxicological Profile for Plutonium » [PDF], Toxic Substances Portal, sur ATSDR - Plutonium, Agency for Toxic Substances and Disease Registry (ATSDR) et U.S. Environmental Protection Agency (EPA), (consulté le ).
- ↑ (en) Jeremy Bernstein, Plutonium : a history of the world's most dangerous element, 2007, Joseph Henry Press, Washington, D.C. (ISBN 978-0-309-10296-4)
- ↑ The Curiosity Mission: Nukes in Space, Karl Grossman.
- ↑ Plutonium Watch: Tracking Plutonium Inventories, ISIS Reports, June 2004.
- ↑ (en) G. A. Turner et D. M. Taylor, « The Binding of Plutonium to Serum Proteins in Vitro », Radiation Research, vol. 36, no 1, , p. 22-30 (PMID 17387923, DOI 10.2307/3572534, JSTOR 3572534, lire en ligne)
- ↑ (en) A. R. Chipperfield et D. M. Taylor, « Binding of Plutonium to Glycoproteins in Vitro », Radiation Research, vol. 43, no 2, , p. 393-402 (PMID 5465552, DOI 10.2307/3573043, JSTOR 3573043, lire en ligne)
- ↑ (en) Mark P. Jensen, Drew Gorman-Lewis, Baikuntha Aryal, Tatjana Paunesku, Stefan Vogt, Paul G. Rickert, Soenke Seifert, Barry Lai, Gayle E. Woloschak et L. Soderholm, « An iron-dependent and transferrin-mediated cellular uptake pathway for plutonium », Nature Chemical Biology, vol. 7, no 8, , p. 560-565 (PMID 21706034, PMCID 3462652, DOI 10.1038/nchembio.594, lire en ligne)
- ↑ (en) John R. Cooper et Helen S. Gowing, « The Binding of Americium and Curium to Human Serum Proteins », International Journal of Radiation Biology and Related Studies in Physics, Chemistry and Medicine, vol. 40, no 5, , p. 569-572 (PMID 6975262, DOI 10.1080/09553008114551541, lire en ligne)
- ↑ (en) David M. Taylor et George J. Kontoghiorghes, « Mobilisation of plutonium and iron from transferrin and ferritin by hydroxypyridone chelators », Inorganica Chimica Acta, vol. 125, no 3, , L35-L38 (DOI 10.1016/S0020-1693(00)84710-6, lire en ligne)
- ↑ (en) David M. Taylor, Arnulf Seidel, Felicitas Planas-Bohne, Ute Schuppler, Margarethe Neu-Müller et Rainer E. Wirth, « Biochemical studies of the interactions of plutonium, neptunium and protactinium with blood and liver cell proteins », Inorganica Chimica Acta, vol. 140, , p. 361-363 (DOI 10.1016/S0020-1693(00)81124-X)
- ↑ (en) F. W. Bruenger, B. J. Stover et W. Stevens, « 239Pu(IV): its subcellular distribution and association with ferritin in the canine liver », Health Physics, vol. 21, no 5, , p. 679-687 (PMID 5112182, DOI 10.1097/00004032-197111000-00009, lire en ligne)
- ↑ (en) G. Boocock, C. J. Danpure, D. S. Popplewell et D. M. Taylor, « The Subcellular Distribution of Plutonium in Rat Liver », Radiation Research, vol. 42, no 2, , p. 381-396 (PMID 4315168, DOI 10.2307/3572805, JSTOR 3572805, lire en ligne)
- ↑ (en) N. P. Singh, M. D. E. Wrenn et S. A. Ibrahim, « Plutonium concentration in human tissues: comparison to thorium », Health Physics, vol. 44, no Suppl. 1, , p. 469-476 (PMID 6862922, DOI 10.1097/00004032-198306001-00045, lire en ligne)
- ↑ (en) « Appendix D. Overview of basic radiation physics, chemistry, and biology » [PDF], Toxic Substances Portal, sur ATSDR - Plutonium, Agency for Toxic Substances and Disease Registry (ATSDR) et U.S. Environmental Protection Agency (EPA), (consulté le ), p. D-4.
- ↑ (en) K. Konzen et R. Brey, « Development of the Plutonium-DTPA Biokinetic Model », Health Physics, vol. 108, no 6, , p. 565-573 (PMID 25905517, DOI 10.1097/HP.0000000000000283, lire en ligne)
- ↑ (en) M. Alex Brown, Alena Paulenova et Artem V. Gelis, « Aqueous Complexation of Thorium(IV), Uranium(IV), Neptunium(IV), Plutonium(III/IV), and Cerium(III/IV) with DTPA », Inorganic Chemistry, vol. 51, no 14, , p. 7741-7748 (PMID 22738207, DOI 10.1021/ic300757k, lire en ligne)
- ↑ (en) F.Ménétrier, L.Grappin, P.Raynaud, C.Courtay, R.Wood, S.Joussineau, V.List, G. N. Stradling, D. M. Taylor, Ph. Bérard, M. A. Morcillo et J.Rencova, « Treatment of accidental intakes of plutonium and americium: Guidance notes », Applied Radiation and Isotopes, vol. 62, no 6, , p. 829-846 (PMID 15799861, DOI 10.1016/j.apradiso.2005.01.005, lire en ligne)
- ↑ (en) A. L. Sérandour, N. Tsapis, C. Gervelas, G. Grillon, M. Fréchou, J. R. Deverre, H. Bénech, E. Fattal, P. Fritsch et J. L. Poncy, « Decorporation of plutonium by pulmonary administration of Ca-DTPA dry powder: a study in rat after lung contamination with different plutonium forms », Radiation Protection Dosimetry, vol. 127, nos 1-4, , p. 472-476 (PMID 17562654, DOI 10.1093/rpd/ncm300, lire en ligne)
- ↑ (en) David M. Taylor, Susan A. Hodgson et Neil Stradling, « Treatment of human contamination with plutonium and americium: would orally administered Ca- or Zn-DTPA be effective? », Radiation Protection Dosimetry, vol. 127, nos 1-4, , p. 469-471 (PMID 17556346, DOI 10.1093/rpd/ncm299, lire en ligne)
- ↑ (en) Pihong Zhao, Vadim V. Romanovski, Donald W. Whisenhunt Jr, Darleane C. Hoffman, Thomas R. Mohs, Jide Xu et Kenneth N. Raymond, « Extraction of plutonium by chelating hydroxypyridinone and catecholamide resins », Solvent Extraction and Ion Exchange, vol. 17, no 5, , p. 1327-1353 (DOI 10.1080/07366299908934651, lire en ligne)
- ↑ (en) V. Volf, R. Burgada, K. N. Raymond et P. W. Durbin, « Early Chelation Therapy for Injected Pu-238 and Am-241 in the Rat: Comparison of 3,4,3-LIHOPO, DFO-HOPO, DTPA-DX, DTPA and DFOA », International Journal of Radiation Biology, vol. 63, no 6, , p. 785-793 (PMID 8100266, DOI 10.1080/09553009314552191, lire en ligne)
- ↑ (en) A. Blanchard, K. R. Yates, J. F. Zino, D. Biswas, D. E. Carlson, H. Hoang et D. Heemstra, « Updated Critical Mass Estimates for Plutonium-238 », sur osti.gov, U.S. Department of Energy: Office of Scientific & Technical Information (consulté le ).
- ↑ (en) John Malik, « The Yields of the Hiroshima and Nagasaki Nuclear Explosions » [PDF], sur fas.org, Laboratoire national de Los Alamos, (consulté le ).
- (en) C. E. Till, Y. I. Chang, Plentiful Energy: The Story of the Integral Fast Reactor, the Complex History of a Simple Reactor Technology, with Emphasis on Its Scientific Basis for Non-specialists, 2011, Charles E. Till and Yoon Il Chang, pp. 254-256. (ISBN 978-1-4663-8460-6)
- ↑ (en) (en) « Plutonium Storage at the Department of Energy's Savannah River Site: First Annual Report to Congress » [PDF], sur dnfsb.gov, Defense Nuclear Facilities Safety Board, (consulté le ), A-1.
- ↑ (en) Theodore M. Besmann, « Thermochemical Behavior of Gallium in Weapons-Material-Derived Mixed-Oxide Light Water Reactor (LWR) Fuel », Journal of the American Ceramic Society, vol. 81, no 12, , p. 3071–3076 (DOI 10.1111/j.1151-2916.1998.tb02740.x, lire en ligne)
- ↑ (en) « Huge radioactive leak closes Thorp nuclear plant », sur theguardian.com, The Guardian, (consulté le ).
- ↑ (en) « From heat sources to heart sources: Los Alamos made material for plutonium-powered pumper », sur lanl.gov, Laboratoire national de Los Alamos (consulté le ).
- ↑ (en) « Why the Cassini Mission Cannot Use Solar Arrays », sur web.archive.org, Jet Propulsion Laboratory, (consulté le ).
- ↑ (en) « Voyager Spacecraft »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?), sur jpl.nasa.gov, Jet Propulsion Laboratory (consulté le ).
- ↑ (en) Venkateswara Sarma Mallela, V. Ilankumaran et N.Srinivasa Rao, « Trends in Cardiac Pacemaker Batteries », Indian Pacing and Electrophysiology Journal, vol. 4, no 4, , p. 201-212 (PMID 16943934, PMCID 1502062, lire en ligne)
- ↑ (en) « Plutonium Powered Pacemaker (1974) », sur orau.org, Oak Ridge Associated Universities (en), (consulté le ).
- ↑ (en) « Plutonium », sur world-nuclear.org, Association nucléaire mondiale (consulté le ).
- ↑ « Code de la défense », sur legifrance.gouv.fr (consulté le ).
- ↑ Henri Métivier, « Plutonium - Mythes et réalités » (consulté le ).
- ↑ Plutonium production, Federation of American Scientists.
- ↑ (en) E.F. Hammel, « The taming of "49" — Big Science in little time. Recollections of Edward F. Hammel », Los Alamos Science, Vol 26, Iss. 1, 2000 (consulté le ). Cette convention a été étendue pour tous les actinides, dans les équations décrivant la dynamique de leur population dans des réacteurs. Ainsi, l'isotope 235 de l'uranium (92) reçoit dans les équations l'indice 25 et ainsi de suite.
- ↑ (en) D. C. Hoffman, F. O. Lawrence, J. L. Mewherter et F. M. Rourke, « Detection of Plutonium-244 in Nature », Nature, vol. 234, no 5325, , p. 132-134 (DOI 10.1038/234132a0, Bibcode 1971Natur.234..132H, lire en ligne)
- ↑ Rapport Bataille 1997/1998 au Sénat.
- ↑ (en) « Alternatives to MOX - Direct-disposal options for stockpiles of separated plutonium », sur fissilematerials.org, (consulté le ).
Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- (en) David R. Lide et al., Handbook of Chemistry and Physics, Boca Raton (FL), CRC Press, Taylor & Francis Group, , 87e éd., 2608 p. (ISBN 0-8493-0487-3)
- Sandrine Matton ; Mesures in vitro et in vivo des paramètres de dissolution des oxydes mixtes d'uranium et de plutonium en milieu biologique (In vitro and in vivo measurements of dissolution parameters of mixed uranium and plutonium oxides in biological medium) ; Thèse de Sandrine Matton (sous la direction de Michel Genet), soutenue à l'université de Paris 11 Orsay (Inist CNRS)
- IEER, Énergie & Sécurité no 3 Sommaire : L'utilisation du plutonium militaire comme combustible de réacteur ; Les effets du plutonium sur la santé ; Le MOX en France et en Belgique ; Situation et perspective pour la production du combustible MOX en Russie ; La transmutation n'est pas une alternative à l'enfouissement ; La transformation du plutonium avec le temps], Énergie & Sécurité no 3, 1997 (scan PDF)
Articles connexes
[modifier | modifier le code]Liens externes
[modifier | modifier le code]- (en) « Technical data for Plutonium » (consulté le ), avec en sous-pages les données connues pour chaque isotope
- (en) Les expérimentations humaines sur le plutonium aux États-Unis (Los Alamos Science, 23, 1995)
- (en) Plutonium, par le "World Nuclear Association"
- « Les isotopes du plutonium et leurs descendants dans le nucléaire civil »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le ), rapport à l'Académie des sciences par Robert Dautray - Paris - - Éditions Tec & Doc Lavoisier.
- Plutonium, Mythes et Réalités - Janvier 2010 - EDP Sciences.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux alcalins | Métaux alcalino-terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métalloïdes | Non-métaux | Halogènes | Gaz nobles | Éléments non classés |
| Actinides | |||||||||
| Superactinides |
 KSF
KSF

![Plutonium vu par la tranche sur le salt cake issu du procédé multicycle de réduction directe d'oxyde (MCDOR) : le dioxyde de plutonium PuO2 est dissous dans le chlorure de calcium CaCl2 fondu de 820 à 875 °C dans un creuset en oxyde de magnésium MgO pour y être réduit en plutonium métallique[5].](https://upload.wikimedia.org/wikipedia/commons/a/a4/Pu%2C94.jpg)

![{\displaystyle \mathrm {\xrightarrow[{23.5\ min}]{\beta ^{-}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/f7a91aa1a6ff0b2763a640151dce5797a76165f7)
![{\displaystyle \mathrm {\xrightarrow[{2.3565\ d}]{\beta ^{-}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/7a21e2d7d99345c4b8953cd85639c4bb6c936aeb)
![{\displaystyle \mathrm {\xrightarrow[{2{,}117\;\mathrm {j} }]{\beta ^{-}}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1f755a5bcc4681f2724bfd8940088cf77a9669f3)