Toxicologie
 From Wikipedia (Fr) - Reading time: 33 min
From Wikipedia (Fr) - Reading time: 33 min
La toxicologie est une discipline scientifique qui étudie les effets néfastes d'une source — molécule, radiation, nanomatériaux, etc. — sur des organismes ou des systèmes biologiques. Elle est à l'interface entre plusieurs disciplines — chimie, physiopathologie, pharmacocinétique, pharmacologie, médecine, etc. —, la toxicologie s'applique à un toxique ou une association comme un produit fini qui contient plusieurs constituants. Elle s'intéresse à l'étiologie (origine) des toxiques et des intoxications, aux propriétés physiques et chimiques des toxiques, aux circonstances de contact avec l'organisme et au devenir du toxique dans l'organisme (administration, distribution, métabolisme, élimination) ; aux effets néfastes sur un organisme ou un groupe d'organismes ou sur l'environnement (écotoxicologie) et à leurs mécanismes ; à la détection des toxiques (moyen, qualité, quantité) ; aux moyens pour combattre les toxiques (voies d'élimination, antidotes, traitement) ; aux méthodes de prévention, au diagnostic, au pronostic, à la surveillance médicale, etc.
Elle étudie les interactions nocives entre des substances chimiques et les systèmes biologiques.
Un toxique est un produit qui pénètre dans l'organisme avec des effets néfastes. Il se distingue de la toxine qui est une substance toxique synthétisée par un organisme vivant (bactérie, champignon vénéneux, insecte ou serpent venimeux, etc.), auquel elle confère un pouvoir pathogène ou dangereux.
Histoire
[modifier | modifier le code]Préhistoire
[modifier | modifier le code]Une lecture de certaines peintures rupestres préhistoriques suggérerait[1],[2] qu'elles auraient été réalisées dans des états de transe. Des hallucinogènes pourraient être à l'origine de ces états. Ces interprétations sont aussi étayées par des études archéologiques sur l'utilisation des psychotropes pendant la préhistoire[3],[4].
Certaines recherches suggèrent l'utilisation de poisons depuis le Paléolithique[5].
Des sillons retrouvés sur des armes comme des flèches provenant des temps préhistoriques laissent supposer l'usage d'armes empoisonnées[6]. Les flèches empoisonnées sont mentionnées dans la mythologie grecque. Elles ont été utilisées par les Celtes, les Gaulois et leurs envahisseurs barbares[7],[6].
Égypte ancienne
[modifier | modifier le code]Les anciens Égyptiens ont fait des observations détaillées concernant les serpents venimeux et les scorpions de leur pays. Les identifications des espèces, les effets de leurs morsures, les traitements et les pronostics sont bien documentés. L'expérience les aurait amenés à prescrire des plantes médicinales potentiellement toxiques, également bien documentées, à des doses thérapeutiques. La toxicité du plomb, utilisé par les Égyptiens dans les fards et le mascara, n'était en revanche pas connue[8].

Le papyrus d'El-Lahoun datant du règne de Amenemhat II et de Sésostris II, son successeur, listent des préparations contraceptives sous forme de comprimé vaginal à base de gomme d'acacia, de lait tourné, d'excrément de crocodile et de natron mélangés à des fibres végétales et du miel. Les recherches modernes ont montré que l'acacia avait une activité spermicide[9].
Le papyrus Ebers, datant d'environ 3 500 ans, aborde la toxicologie, dont l'étiologie des désordres mentaux pouvant être attribuée aux poisons dans un chapitre du papyrus appelé le « Livre des cœurs ». Ce papyrus décrit aussi des méthodes de contraception[9],[10].
Époque biblique
[modifier | modifier le code]Dans l'Ancien Testament, la consommation excessive de vin est condamnée[11].
Un texte hébreu relate que Moïse connaissait le danger de la préparation des aliments dans des vases de cuivre. Des missionnaires d'Orient rapportèrent des traités concernant les poisons et les contre-poisons depuis la plus haute antiquité[7].
Grèce et Rome antiques
[modifier | modifier le code]-
Buste de Pythagore, jardins de la villa Borghèse.
-
La mort de Socrate, par Jacques-Louis David, 1787.
-
Tuyaux de plomb romains retirés du Rhône en France.
Pythagore, philosophe présocratique, recommandait de s'abstenir des fèves[12]. C'est le Grec Hippocrate qui a observé le premier que selon la dose et le mode d'administration, une substance passe du remède au poison et inversement. Le principe de la dose a été ensuite repris par Paracelse, un médecin suisse du XVe siècle[13].
Le grec Nicandre de Colophon avait listé des toxiques, leurs actions et des contre-poisons[14]. À peu près à la même période, Héraclite de Tarente, contemporain d’Asclépiade de Bithynie, fut un des fondateurs de la pharmacologie et de la toxicologie.
Mithridate VI, roi du Pont, serait parvenu à supporter des poisons en absorbant des doses journalières infimes, il aurait aussi fabriqué un antidote qui porte son nom[15]. Les Grecs et les Romains connaissaient les dangers du plomb, la phrase « L'eau transportée dans les tuyaux en terre est plus saine que celle acheminée dans le plomb » est attribuée à Vitruve, un architecte romain[13].
Intoxications humaines
[modifier | modifier le code]- Shennong, un empereur chinois, aurait découvert les herbes médicinales et serait mort d'une overdose toxique[16].

- Socrate est condamné à mort par ingestion d'une solution à base de ciguë[17].
- Près de la mer Noire, dans le pays du Pont, les troupes de Xénophon trouvèrent des ruches : ignorant que les abeilles avaient butiné des rhododendrons pontiques, ceux qui consommèrent le miel eurent des vomissements, des vertiges et durent être purgés. Pline l'Ancien mentionne plusieurs miels empoisonnés : il cite un miel qui provoque la folie et peut induire la mort[18].
Intoxications de la faune
[modifier | modifier le code]Homère connaissait les propriétés fongicides du soufre et le décrivait « comme éloignant la vermine »[19]. L'arsenic, selon Pline l'Ancien, est recommandé comme insecticide, il a ensuite été utilisé comme raticide[13],[19].
Premier cours de toxicologie en France
[modifier | modifier le code]
Une ordonnance royale du autorise la création d'un cours de toxicologie. Le , Joseph-Bienaimé Caventou en est le titulaire[20].
Éléments clés de la toxicologie
[modifier | modifier le code]
Certains produits présentent une toxicité dose-dépendante et n'apparaissant qu'au-delà d'un certain seuil (pouvant varier selon l'âge et des susceptibilités génétiques ou individuelles). Dans ce cas, comme l'avait décrit Hippocrate, la dose fait le poison. Une accumulation d'un toxique dans l'organisme est possible, la toxicité apparaît lorsque plusieurs doses ont été cumulées (poison cumulatif comme le mercure, le plomb ou le benzène).
Pour certains toxiques, on suspecte ou on a démontré des effets aux faibles doses (perturbateurs endocriniens par exemple), la toxicité est même parfois plus importante aux faibles doses qu'à des doses plus fortes[21],[22],[23]. Une courbe de dose-réponse peut être soit monotone (uniquement ascendante ou descendante) soit non monotone (en forme de U ou U inversé)[22],[21].
La toxicité d'un produit varie avec le moment de l'exposition : embryogenèse, puberté, etc. Il peut exister un délai entre l'exposition et l'apparition de l'effet toxique, par exemple lorsqu'il y a une exposition pendant la grossesse puis apparition des effets toxiques au niveau de la descendance et chez la mère (le cas du diéthylstilbestrol). Il existe dans certains cas des effets transgénérationnels, c'est-à-dire qu'ils qui se transmettent d'une génération à l'autre. La toxicité d'un produit dépend aussi de la durée de l'exposition (aigüe, subaigüe ou chronique).
Les organes cibles dépendent du toxique. Un produit pourra affecter préférentiellement un ou plusieurs organes : cœur, poumons, foie, rein, gonades, œil[24]… Les neurotoxiques affectent le système nerveux. Le terme neurotoxique ne signifie pas que le produit atteint uniquement un organe, d'autres cibles dans l'organisme sont possibles.
L'étiologie des intoxications est variée. Une intoxication peut survenir lors d'un surdosage, d'accidents, de suicide, d'empoisonnement, d'envenimation, d'expositions professionnelles, domestiques, alimentaires, environnementales, médicamenteuses, par des drogues, etc. Les causes d'intoxications (aigües, subaigües ou chroniques) sont parfois difficiles à cerner, notamment dans le cas d'association de plusieurs toxiques.



Les toxiques ont différentes origines, lorsqu'ils proviennent d'un organisme vivant, ils sont dénommés toxines : animaux (venin de la vipère aspic[25], par exemple), végétaux (empoisonnement par la Belladone ou Atropa belladonna, par exemple), champignons (amanite phalloïde, mycotoxine par exemple), bactéries (endotoxine et exotoxine), chimie synthétique ou semi-synthétique (certains médicaments ou certaines drogues par exemple), nanomatériaux (nanoparticules d'argent, de fer, d'aluminium, de dioxyde de titane ou de cérium par exemple), rayonnements électromagnétiques (ultraviolets par exemple), minéraux (arsenic, mercure par exemple), etc.
Il existe différentes voies d'exposition — ingestion, inhalation, passage percutané, etc. — dans un même contexte, elle varie avec l'âge, par exemple les enfants sont plus susceptibles de porter à la bouche des objets contenant des toxiques. L'exposition aux faibles doses est parfois difficile à évaluer. Certaines sous-populations sont plus exposées par exemple par leur métier ou leur environnement. Des biais ou erreurs d'évaluation de l'exposition pourraient expliquer certaines discordances entre les données des études épidémiologiques et toxicologiques[26].
L'étude des toxiques se fait à partir de données humaines provenant des suicides, d'accidents, de surdosage, d'envenimation, d'empoisonnement, d'expositions par le travail, l'alimentation, l'environnement, les médicaments, les drogues, etc. La toxicologie s'appuie sur l'expérimentation animale qui pose des problèmes éthiques, l'extrapolation à l'humain n'est pas toujours évidente. Elle utilise aussi des méthodes in vitro qui ne peuvent pas répondre comme le ferait un organisme réel et des modèles mathématiques et bioinformatiques qui permettent d'approcher certaines situations. Elle s'intéresse aux études épidémiologiques et cliniques, aux données de pharmacovigilance, règlementaires et bibliographiques. Dans sa partie règlementaire, la toxicologie étudie et analyse expérimentalement la toxicité des produits avant leur commercialisation.
Toxicologie médicale, hospitalière et médecine du travail
[modifier | modifier le code]Les grecs et romains savaient déjà que les travailleurs de plomb et du mercure ne vivaient pas longtemps. Il y a plus de 3 siècles (au début du 18e siècle), Bernardino Ramazzini, médecin italien écrivait que : « les ouvriers exerçant des métiers tels que ceux de « mineur », « verrier », « ouvrier en bois », « tisserand », « imprimeur », « potier d’étain », « peintre » (exposé à divers pigment à base de plomb et d'autres métaux toxiques), ou encore ceux qui travaillent l’asbeste (amiante), sont victimes de la toxicité des substances et poussières au contact desquelles ils travaillent[27]. Pour lui, tout médecin se devait d’être attentif au métier de ses malades »[28].
L'intoxication est un processus dynamique et parfois multifactoriel. Elle relève souvent d'une procédure d'urgence mobilisant le clinicien dans une démarche d'évaluation et de soins impliquant plusieurs approches :
- diagnostique ;
- analytique incluant l'interprétation des résultats des analyses biologiques ;
- thérapeutique : réanimation, traitement symptomatique, antidote, élimination du toxique.
Le clinicien interagit avec le biologiste médical (réalisation des analyses biologiques) et le toxicologue hospitalier.
Le toxicologue peut s'appuyer sur des références bibliographiques, des bases de données (médecine d'urgence ou centre antipoison par exemple), des fiches de sécurité fournies par les fabricants de produits chimiques, produites par divers organismes (Institut national de l'environnement industriel et des risques (INERIS) ou Institut national de recherche et de sécurité (INRS) par exemple). D'autres ressources sont possibles comme des livres qui abordent la toxicologie d'urgence[29], la toxicologie clinique[30], etc.
Centres antipoison
[modifier | modifier le code]Les centres antipoison (CAP) sont des centres d'information sur les risques toxiques de tous les produits médicamenteux, industriels et naturels. Ils ont un rôle d'information auprès des professionnels de santé et du public, assurent la diffusion de brochures et apportent une aide par téléphone au diagnostic, à la prise en charge et au traitement des intoxications. Ils participent activement à la Toxicovigilance. Certains centres font en plus de la recherche et des analyses spécifiques.
La toxicologie en France
[modifier | modifier le code]Le plan national santé-environnement (PNSE) depuis 2004 a contribué au développement de la Toxicologie en France. Des projets de recherche sont consacrés à la toxicologie (Toxalim), le plan écophyto essaye de réduire et sécuriser l'utilisation des produits phytosanitaires, des programmes ont été consacrés aux perturbateurs endocriniens, aux nanoparticules, au chlordécone, etc. Des expertises collectives ont été réalisées comme « Reproduction et environnement » en 2011 ou « Pesticides : effets sur la santé » en 2013 par l'INSERM, ainsi qu'un ouvrage de synthèse dans le cadre de différents programmes comme Toxicologie nucléaire environnementale ou Envirhom[31]. Il existe aussi une mission interministérielle nommée MILDECA chargée de la lutte contre les drogues et les conduites addictives.

À la suite des demandes du Grenelle de l'environnement (2007), un pôle national applicatif en toxicologie et écotoxicologie a été lancé début 2009 à l'INERIS. Organisé autour du partenariat entre l'INERIS, l'université de technologie de Compiègne (UTC), l'université de Picardie Jules-Verne, et l'Institut polytechnique LaSalle Beauvais, ce pôle s'appuie notamment sur le réseau scientifique ANTIOPES (CEA, Inserm, CRITT-chimie-PACA, INRA, université de Marseille, université de Paris VII et l'université de Metz) et doit permettre le développement de méthodes prédictives ou d'outils prédictifs. Ce réseau essaye de répondre aux exigences du règlement européen REACH.
Une surveillance des milieux aquatiques permettant de mesurer la toxicité des substances chimiques est assurée par le consortium AQUAREF qui regroupe plusieurs organismes dont l'INERIS.
L'INERIS a établi des partenariats avec le CEA pour les nanoproduits, l'ONEMA pour la pollution chimique de l'eau ou l'EDF pour la surveillance du milieu écologique.
Voies d'administration
[modifier | modifier le code]Des atteintes toxiques de l'embryon et du fœtus sont possibles par passage placentaire ou atteinte du placenta. Différentes voies d'administration sont envisageables : orale, oculaire, parentérale, pulmonaire, percutanée, vaginale, rectale, allaitement, etc. Certaines voies sont plus spécifiques ou plus probables à un certain âge de la vie postnatale comme l'allaitement chez le nouveau-né.
Intoxication par voie orale
[modifier | modifier le code]
Cette voie est la plus fréquente lors des intoxications. Une absorption du toxique est nécessaire pour que celui-ci passe dans l'organisme.
Sites d'absorption du toxique et temps de transit
[modifier | modifier le code]La cavité buccale est propice à l'absorption mais est peu impliquée dans les intoxications. Le transit est rapide dans l'œsophage (de l'ordre des secondes) bien qu'il puisse être ralenti par l'adhésion des formes solides sur la paroi (position couchée, faible volume de liquide, nombre d'unités avalées).
L'estomac n'est pas le lieu de l'absorption du toxique sauf exception, c'est l'endroit où se désintègrent ou se dissolvent les formes solides et les produits, la durée de la vidange gastrique (de 30 minutes à plusieurs heures) est variable. Le toxique doit franchir le pylore pour arriver dans l'intestin. L'ouverture du pylore est rythmique et son passage est un élément déterminant de la vitesse d'absorption des produits.
L'absorption se fait majoritairement dans l'intestin grêle avec un temps de transit moyen de 4-5 heures. Elle est favorisée lorsque les molécules sont solubilisées par un flux sanguin élevé, par la surface de l'épithélium, les sécrétions biliaire et pancréatique. Des enzymes du métabolisme et des transporteurs sont présents au niveau de la bordure en brosse de l'intestin grêle, les transporteurs facilitent ou empêchent l'absorption intestinale des produits de façon sélective.
Une zone de stagnation est possible à la jonction entre l'iléon et le colon dont la durée est de 2 à 20 heures. Le côlon est aussi une zone d'absorption, la durée de transit est d'une dizaine d'heures à plusieurs jours.
Certains métabolites des toxiques formés dans le foie sont éliminés par voie biliaire et se retrouve dans le duodénum, ils subissent le cycle entérohépatique. Ces métabolites subissent ensuite une réabsorption intestinale[32],[33],[34].
Facteurs qui modulent l'absorption
[modifier | modifier le code]Influences de l'estomac et du pylore sur la vitesse d'absorption
[modifier | modifier le code]L'alimentation et des spasmes du pylore (provoqués par de fortes doses de barbituriques par exemple) ralentissent la vidange gastrique. L'ouverture du pylore est sous l'influence de pathologies, des accélérateurs (médicaments par exemple) ou des ralentisseurs (alimentation, médicaments par exemple) de la vidange gastrique et de la posture de l'individu (accélération en position verticale). La formation d'agrégats quand il y a ingestion d'une quantité importante d'un toxique solide ou de précipité pour certains principes actifs augmente le temps de stagnation dans l'estomac.
Motilité intestinale
[modifier | modifier le code]La perturbation de la motilité intestinale a des répercussions sur l'absorption intestinale, une diminution de la motilité intestinale ralentit l'absorption mais augmente les quantités absorbées car les produits restent plus longtemps en contact avec les sites d'absorption. L'hypotension, l'hypothermie, l'activité anticholinergique de certains toxiques diminuent la motilité intestinale.
Saturation
[modifier | modifier le code]Si les transporteurs intestinaux favorisant l'absorption sont saturés dans le cas de doses trop élevées, les molécules ne sont plus absorbées et restent alors plus longtemps dans l'intestin. Si le métabolisme au niveau du foie est saturé, la formation des métabolites sera diminuée et donc leur cycle entérohépatique aussi.
Propriétés des molécules
[modifier | modifier le code]Les caractères physico-chimiques des molécules modulent l'absorption intestinale. La taille, l'hydrophilie et le degré d'ionisation (passage uniquement de la forme non ionisée) des molécules sont des facteurs limitants. Certaines molécules comme des protéines par leur haut poids moléculaire et leur dégradation dans le milieu gastrointestinal ne seront pas absorbées.
Association (produits, aliments)
[modifier | modifier le code]Les associations produit-alimentation ou de plusieurs produits peuvent limiter ou augmenter l'absorption d'un ou plusieurs toxiques. Ces phénomènes peuvent être liés à des réactions chimiques locales ou aux propriétés physico-chimiques du produit. Le calcium provenant de l'alimentation forme un complexe insoluble avec la tétracycline et empêche l'absorption de cet antibiotique. Ces phénomènes sont aussi observés lorsque certains aliments comme les jus d'agrumes notamment le jus de pamplemousse modifient la vidange gastrique, le temps de transit intestinal, la dissolution du médicament ou l'activation/inhibition des enzymes du métabolisme intestinal et des transporteurs intestinaux.
Intoxication par inhalation
[modifier | modifier le code]
Les particules, les aérosols, les fumées, les vapeurs s'engouffrent dans l'arbre pulmonaire[35],[36]. Il existe trois zones de dépôt dans l'appareil respiratoire : les régions nasopharyngée, trachéobronchique et alvéolaire. Le dépôt des particules se fait par différents mécanismes : la sédimentation (grosses particules), l'impaction au niveau des bifurcations bronchiques et la diffusion. L'endroit du dépôt dépend surtout de la taille des particules, les particules fines se déposent dans le poumon profond contrairement aux particules plus grosses. D'autres paramètres peuvent intervenir comme la porosité. Des particules poreuses de grande taille pourront atteindre le poumon profond à cause de leur faible densité. Le dépôt des particules est sujet à des variations intra- et interindividuelles, la capacité respiratoire et des pathologies telles que l'asthme sont des facteurs de variation.
L'élimination dans les voies aériennes supérieures est rapide (24 heures) et est assurée par la clairance mucociliaire : mucus et battements des cils. Le mucus est ensuite dégluti, transférant certains polluants vers le système digestif.
Au niveau alvéolaire, l'élimination est assurée par la phagocytose des macrophages pour les particules pas trop grosses et est plus lente (plusieurs mois), il peut y avoir une accumulation s'il existe une surcharge. Les propriétés physico-chimiques (solubilité par exemple) des particules vont déterminer leur persistance dans l'arbre bronchique et les interactions avec les composés du liquide bronchoalvéolaire, une phagocytose sera parfois possible par les cellules épithéliales ainsi qu'une translocation vers des organes secondaires[35].
Pour les molécules, l'élimination du poumon se fait par une diffusion active ou passive vers le réseau de capillaires sanguins puis passage vers la circulation systémique. Il existe aussi au niveau pulmonaire des enzymes de métabolisation qui permettent une élimination de la molécule mère du poumon[36].
Intoxication par voie cutanée
[modifier | modifier le code]
La peau et plus encore les muqueuses sont une porte d'entrée pour certains toxiques.
Pour une absorption transcutanée, le produit appliqué sur la peau doit franchir la couche cornée. Le produit diffuse ensuite à travers les autres couches de la peau. Les sites d'action des produits se situent au niveau de l'épiderme et du derme. L'activité du produit au niveau local peut être obtenue après métabolisation.
La couche cornée fonctionne comme une barrière et un réservoir, elle libère pendant plusieurs heures les produits appliqués à la surface de la peau avec une phase de latence. Les molécules passent cette couche majoritairement par la voie intercellulaire, il existe d'autres voies de passage (transcellulaire, folliculaire).
La diffusion passive du produit à travers la peau se fait selon la loi de Fick. Elle dépend de la surface d'application, de la concentration et des caractères physicochimiques — hydrophilie/lipophilie, charge électrique, etc. — du produit.
L'excipient a un rôle important, il prolonge le contact du principe actif avec la couche cornée et favorise sa pénétration, il doit aussi permettre la diffusion dans les autres couches de la peau.
L'élimination du produit de la peau se fait par passage dans la circulation sanguine principalement au niveau du derme. Une exfoliation en surface du produit et de ses métabolites est aussi possible[37],[38][source insuffisante].
Variations de l'absorption avec l'âge
[modifier | modifier le code]Chez le prématuré, l'absorption est plus importante car la couche cornée est plus mince. Chez l'enfant, le risque d'intoxication est accru car le rapport surface/poids est augmenté par rapport à l'adulte. Chez la personne âgée, l'hydratation de la peau est plus faible et donc l'absorption des molécules hydrophiles est diminuée[37],[38].
La peau : un facteur influençant l'absorption
[modifier | modifier le code]La composition de la couche cornée et la densité des annexes pilosébacées sont variables selon les régions, certaines régions sont donc plus perméables que d'autres.
Des lésions de la peau augmentent l'absorption. Ces modifications sont dues à des pathologies, des agents chimiques ou physiques, etc. Dans la nécrose épidermique toxique, l'absence de l'épiderme augmente le passage transcutané des topiques. L'hydratation, la vasodilatation et la chaleur observées au cours de l'occlusion favorisent ce passage. L'occlusion augmente aussi l'effet réservoir[37],[38].
Effets allergiques et toxiques
[modifier | modifier le code]Les effets secondaires sont surtout situés au niveau local. Des irritations, de l'urticaire, de l'eczéma, des allergies peuvent par exemple être observés lors d'exposition à des toxiques. Des accidents allergiques systémiques comme l'urticaire généralisée et le choc anaphylactique sont rares et indépendants de la dose. Des effets toxiques systémiques (neurologiques, digestifs par exemple) qui dépendent de la dose sont aussi possibles, différents produits ne doivent pas être utilisés comme l'acide borique ou le camphre en particulier chez l'enfant[37].
Les mécaniciens et les garagistes, exposés par exemple aux hydrocarbures aromatiques polycycliques (HAP) des pneus, peuvent mieux se protéger en utilisant des gants[39].
Passage placentaire
[modifier | modifier le code]D'après[40].
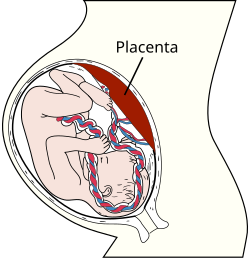
Pendant la grossesse, les toxiques ont la possibilité d'atteindre l'embryon ou le fœtus. Le passage à travers le placenta est bidirectionnel, les toxiques présents dans le compartiment fœtal peuvent rejoindre le compartiment maternel.
Différentes voies de passage existent. La diffusion passive dépendante du gradient de concentration augmente avec le déroulement de la grossesse car l'épaisseur du placenta diminue. Un passage non dépendant du gradient de concentration se fait grâce à des transporteurs d'efflux ou d'influx qui limitent ou favorisent respectivement le passage des molécules vers le compartiment fœtal. L'endocytose est une voie de passage pour les immunoglobulines (anticorps, molécules du complexe majeur d'histocompatibilité…).
Une métabolisation du toxique est possible au niveau du placenta, ce dernier contient des enzymes de métabolisation. Si cette dernière est complète, ce sont uniquement les métabolites qui pourront être présents au niveau du compartiment fœtal. Les molécules qui ont un poids moléculaire élevé ne pourront pas franchir le placenta, la plupart des molécules ont la capacité de passer le placenta.
Risques liés à une exposition in utero
[modifier | modifier le code]Trop de femmes enceintes prennent des médicaments sans toujours savoir s'il y a un risque pour le fœtus. Étant donné l'existence des risques potentiels tératogènes et fœtotoxiques, il est important de limiter au maximum la prise de médicaments pendant une grossesse et de privilégier les règles hygiénodiététiques[41].
Risques malformatifs
[modifier | modifier le code]Ce risque est maximal lorsque l'exposition a lieu pendant la période de l'embryogenèse (deux premiers mois). Au cours de cette période, les organes se forment (organogenèse). Certains systèmes (S.N.C., appareil reproducteur par exemple) continuent à se mettre en place après cette période. Certaines malformations ne sont pas viables.
Risque fœtotoxique
[modifier | modifier le code]Ce risque correspond surtout à une atteinte fonctionnelle des organes ou à un retard de croissance intra-utérin. Les effets toxiques sur le fœtus peuvent induire la mort in utero, modifier le fonctionnement d'un organe pendant la vie utérine (atteinte du rein avec des antihypertenseurs comme les inhibiteurs de l'enzyme de conversion) ou avoir des répercussions plus tardivement après la naissance (développement de cancer de l'appareil reproducteur après une exposition in utero au diéthylstilbestrol).
Risques après la naissance
[modifier | modifier le code]Le fœtus a été en contact avec des toxiques in utero. Des risques existent juste après la naissance soit parce qu'il y a eu un arrêt de l'exposition (sevrage) soit parce que le toxique persiste chez le nouveau-né (imprégnation). Dans certains cas, l'imprégnation se poursuit par le sevrage.
Imprégnation
[modifier | modifier le code]L'exposition a lieu avant ou jusqu'à l'accouchement. Le toxique persiste plusieurs jours chez le nouveau-né parce que la demi-vie d'élimination du toxique est longue et les systèmes d'élimination sont immatures. Les effets observés correspondent à des effets pharmacologiques et toxiques.
Sevrage
[modifier | modifier le code]L'arrêt de l'exposition se fait juste avant ou au moment de l'accouchement. Les effets observés sont ceux qui apparaissent chez l'adulte lors de l'arrêt de certaines molécules (syndrome de sevrage) qui induisent une dépendance (opiacés par exemple).
Effets pendant le développement postnatal
[modifier | modifier le code]Une exposition à des toxiques pendant la vie intra-utérine peut avoir des répercussions à la naissance, pendant l'enfance, au moment de la puberté, à l'âge adulte. Certains cancers apparaissent après la naissance alors que l'exposition a eu lieu pendant la grossesse, l'exemple typique est celui du diéthylstilbestrol. Certains effets se transmettent de génération en génération.
Moyens de mesure de la toxicologie
[modifier | modifier le code]On cherche à mesurer et quantifier, pour une dose donnée ou une gradation de dose, la nature et les effets des intoxications (quelles que soient leur origine).
On s'intéresse surtout à deux paramètres :
- la gravité des effets : cumulatifs ou non, « dose-dépendants » ou non, réversibles ou non, mortels ou non, etc. ;
- le temps d'apparition des effets (après une exposition aigüe ou chronique, pendant l'embryogenèse, la puberté, à l'âge adulte, etc.).
L'intoxication peut dépendre d'effet de seuil, on définit par exemple un seuil quand on n'observe pas d'effet toxique en dessous d'une certaine dose administrée. Le toxicologue se réfère à de nombreuses références qui sont des seuils, des normes, des doses tolérables ou admissibles, etc. Ces références correspondent aux Valeurs Toxicologiques de Référence ou V.T.R., certaines sont avec seuil et d'autres sans seuil[42].
La mesure de la toxicité d'un produit (ou d'un mélange) peut se faire en « équivalent-toxique». L'équivalent toxique exprime la toxicité d'un composé par rapport au produit de référence le plus toxique. Un facteur d'équivalence toxique est attribué au composé.
Notions de dose
[modifier | modifier le code]Il existe de nombreuses doses de référence, par exemple[42] :
- la dose journalière admissible (DJA) ou dose journalière tolérable (DJT) (pour les résidus de pesticides ou d'autres molécules comme le bisphénol A[43]) ;
- la dose journalière recommandée (DJR) ;
- la dose hebdomadaire tolérable (DHT) ou dose hebdomadaire tolérable provisoire (DHTP), notion appliquée aux métaux lourds ;
- la « dose limite annuelle » (DLA) (pour les radionucléides) ;
- la dose virtuellement sûre (DVS) ;
- la dose tumorigène 0,05 (DT0,05) ou dose (souvent exprimée en mg/kg par jour) qui induit une augmentation de 5 % de l'incidence des tumeurs ou de la mortalité liée aux tumeurs ;
- la NOAEL (no observed adverse effect level) ou dose sans effet toxique observable : dose la plus élevée pour laquelle aucun effet toxique est observé[43]. Cette référence est calculée lors des études pré-cliniques pour la mise sur le marché d'un médicament par exemple. Elle permet le calcul de la dose pour la première exposition chez l'humain ;
- la LOAEL (lowest observed adverse effect level) (équivalents français : DMEIO (dose minimale ayant un effet indésirable observé), DMENO (dose minimale pour laquelle un effet nocif a été observé)) : dose d'exposition la plus basse, dans une expérience, produisant un effet néfaste observé ;
- la dose létale médiane (DL50) est la dose qui provoque 50 % de mortalité dans un groupe d'animaux définis avec des conditions expérimentales précises. La DL50 est un indicateur quantitatif de la toxicité d'un produit, plus elle est faible, plus le produit est toxique. Elle permet de comparer la toxicité des produits si les conditions expérimentales sont identiques (même voie d'administration par exemple). Elle est par exemple de l'ordre du nanogramme (ng) pour la toxine botulique chez la souris par voie parentérale et de l'ordre du milligramme (mg) pour la strychnine dans les mêmes conditions[44],[45].
Il existe aussi des doses de référence chez l'humain : la dose minimale mortelle pour la strychnine est de 30 à 120 mg chez l'adulte par voie orale et de 15 mg chez l'enfant[45] ; on peut définir aussi des doses toxiques qui sont à comparer aux doses thérapeutiques lorsqu'il s'agit d'un médicament. Idéalement, la dose toxique doit être supérieure à la dose thérapeutique, ce qui n'est pas le cas de la morphine par exemple.
Limites des approches classiques
[modifier | modifier le code]La définition d'une valeur seuil à court terme n'est pas suffisante. Par exemple, le chlorure de vinyle provoque une hépatotoxicité à forte dose et induit des cancers à faible dose après une longue latence. Certains mécanismes doivent être pris en compte lors d'une exposition à faible dose pendant longtemps comme la bioaccumulation[31].
Ces seuils sont calculés pour des toxiques pris individuellement, et non pour un cocktail de molécules. Ces dernières peuvent agir avec des effets antagonistes ou additifs ou de potentialisation/synergie à l'intérieur du cocktail.
De plus, il existe aussi des niveaux de sensibilité liés au patrimoine génétique, à l'état général de santé, à l'histoire immunitaire, et également à l'âge ou au moment de l'intoxication (certains produits auront une action toxique sur le têtard mais pas chez la grenouille).
Le toxicologue doit tenir compte des paramètres pharmacocinétiques et d'éventuelles synergies et interactions métaboliques très complexes. Il approche aujourd'hui les notions de toxicité des molécules, des mélanges et des rayonnements avec des concepts émergents comme les notions d'effets à basses doses ou de « courbes non monotones d'effets »[46] tout en continuant à étudier les effets d'activités anthropiques nouvelles ou productrices de nouveaux contaminants (ex : nanotoxicologie).
Importance de la mesure de l'exposition (individuelle et collective)
[modifier | modifier le code]C'est notamment le domaine de la biosurveillance.
L'exposition à un ou plusieurs toxiques se mesure par :
- l'étude de symptômes ;
- des analyses qualitatives et/ou quantitatives de présence de toxiques (marqueurs d'exposition) dans un milieu biologique (sang, urine par exemple), corrélées avec les symptômes d'une intoxication ;
- l'analyse de biomarqueurs, la créatinémie est utilisée comme biomarqueur de la filtration glomérulaire rénale pour les toxiques affectant le rein par exemple, mais son intérêt est discuté[47] ;
- la traçabilité des expositions professionnelles[48], notamment dans les contextes d'exposition aux rayonnements ionisants et/ou « d’utilisation de substances et préparations, et de mise en œuvre de process, susceptibles d’être à l’origine d’altérations graves de la santé des utilisateurs, s’agissant en particulier des agents et procédés cancérogènes, mutagènes ou reprotoxiques (CMR) ».
Ces données peuvent servir à proposer des modèles toxicologiques, y compris pour les reconstitutions rétrospectives de dose (« modèle inverse »[49]).
La mesure de l'exposition à un produit — par exemple phtalate, PCB, radiation, etc. — est importante pour évaluer la toxicité d'un produit, mais elle est plus délicate qu'il n'y parait :
- l'exposition est estimée par la mesure (chimie analytique) d'un toxique (mercure total par exemple) dans un milieu biologique mais sa forme (spéciation) n'est pas toujours prise en compte ;
- le plus souvent, on évalue l'exposition par la mesure du produit ou des métabolites dans le sang ou l'urine (respectivement plombémie et plomburie pour le plomb dans le sang et l'urine par exemple), or une partie des toxiques peut avoir été excrétée par les poumons (éthanol par exemple) ou les fèces, ou être stockée dans l'os (plomb par exemple) pour être éventuellement libérée plus tard ;
- les molécules de dégradation et les métabolites peuvent être nombreux ou encore inconnus de la science (pour des molécules chimiques synthétiques récentes par exemple), leur détection est alors difficile ;
- les marqueurs d'exposition permettent l'identification du toxique et l'évaluation de son niveau d'exposition. Le problème est que certains marqueurs sont communs à plusieurs toxiques, dans ce cas ils ne permettent pas l'identification du toxique avec certitude. Les signes cliniques et les biomarqueurs constituent alors une aide pour l'identification du toxique. Il existe des valeurs de références (concentrations plasmatiques par exemple) pour certains toxiques. La comparaison de la concentration du toxique obtenue chez le patient par rapport à des valeurs de référence dans le même milieu biologique peut permettre l'estimation de la gravité de l'intoxication : sévère, grave, mortelle, etc. Si le moment de l'intoxication est inconnu, cette estimation est souvent difficile.
La toxicologie est complexe car elle dépend de nombreux facteurs liés au toxique, à l'exposition et à sa victime :
- nature du toxique (ou des toxiques) et de ses effets ;
- moment d'exposition : in utero… ;
- voie d'administration : orale, inhalation, passage percutané ou oculaire, etc. ;
- individus et sous-populations exposées :
- des sous-groupes métaboliques (enfants, personnes âgées, femmes enceintes, femmes ménopausées, etc.) métabolisent différemment certaines substances,
- des sous-groupes génétiques : genre, troubles génétiques sanguins ou immunologiques, métaboliseurs lents ou rapides, etc.,
- des sous-groupes nutritionnels : déficits alimentaires, alcooliques, fumeurs, etc.,
- des sous-groupes « patients fonctionnels » (maladies modifiant la toxicocinétique des xénobiotiques),
- des sous-groupes « patients autres pathologies » : obèses, diabétiques, etc.
C'est pour protéger ces sous-groupes que des facteurs d’incertitudes par défaut sont souvent utilisés lors des calculs des valeurs toxicologiques de référence.
En réalité, tout individu, même en parfaite santé appartient à un sous-groupe sensible au moins à un moment de sa vie : in utero, jeune enfant, personne âgée, etc.
Un exemple de sous-groupe sensible à des risques particuliers pour l'exposition à certains toxiques.
Toxicologie des mélanges
[modifier | modifier le code]Le mélange (binaire ou multicomposants) de différentes substances peut modifier leur toxicité de plusieurs manières[51] :
- effet toxique additif : quand la toxicité d'un mélange est égale à celle prédite par l’addition de la toxicité de chaque composante du mélange ;
- effet toxique supra-additif (synergie ou potentialisation) : quand la toxicité induite par le mélange est plus élevée que la somme de celles qui seraient induites par chaque composant du mélange, un composant (ou plusieurs) augmente la toxicité d'un autre produit (ou de plusieurs autres) ;
- effet toxique infra-additif ou antagoniste : quand le mélange est moins toxique que l'addition de la toxicité de tous ses composants, un composant (ou plusieurs) diminue la toxicité d'un autre produit (ou plusieurs autres).
Inventaire des toxiques
[modifier | modifier le code]
C'est un travail lent et difficile pour plusieurs raisons :
- le nombre des toxiques est élevé, la chimie et les nanotechnologies produisent de nombreux produits, les produits commercialisés sont en augmentation. Le nombre de produits diffusés dans la biosphère et retrouvés dans la chaîne alimentaire a augmenté depuis deux siècles ;
- le contexte mondialisé ne permet pas aujourd'hui de tracer toutes les molécules.
Dans l'Union européenne, le règlement européen REACH impose aux industriels une évaluation des impacts sanitaires des produits les plus utilisés qu'ils fabriquent.
À titre d'exemple, l'INRS a analysé de nombreux produits chimiques pour leurs aspects cancérogènes, mutagènes ou reprotoxiques (CMR).
Typologie ou classification des intoxications
[modifier | modifier le code]Intoxications alimentaires
[modifier | modifier le code]
- Intoxication par les champignons : amanite phalloïde, ergotisme (champignon qui infecte le seigle et d'autres céréales), etc.
- Intoxication par les algues : ciguatera (contamination de la chair des poissons par une microalgue présente dans les récifs coralliens)… ;
- Intoxications par les mycotoxines : moisissures, aflatoxine, ochratoxine A, etc.
- Intoxications par des animaux : poisson fugu (tétrodotoxine présente dans certains organes comme le foie), additifs dans la nourriture d'élevage, etc.
- Intoxications par des végétaux : rhubarbe, phytoœstrogènes (soja par exemple), piment, manioc, amande amère, etc.
- Intoxications par des minéraux : cadmium dans certains mollusques… ;
- Intoxications par des produits qui facilitent l'agriculture : pesticides… ;
- Excès/déficit en vitamines (vitamine A par exemple), en minéraux ;
- Excès de sel, de graisse, de sucre :
- Aliments qui provoquent des allergies : arachide… ;
- Additifs alimentaires, produits synthétiques (caramel par exemple) ;
- Aliments qui modifient le potentiel toxique d'autres aliments : pamplemousse… ;
- Intoxication par l'eau ;
- Produits de fermentation : méthanol… ;
- Cuisson des aliments : benzopyrènes, acroléine, etc.
- Contamination des aliments ; récipients (bisphénol A par exemple), etc.
- Toxi-infection alimentaire collective
- etc.
Les intoxications peuvent aussi être classées selon le toxique : métal, pesticide, perturbateur endocrinien, radiation, etc.
Intoxications par les métaux et métalloïdes
[modifier | modifier le code]- Aluminium
- Antimoine
- Arsenic, avec le cas particulier de l'intoxication chronique par eau contaminée.
- Béryllium
- Iode (isotopes radioactifs)
- Manganèse
- Nitrate d'argent
- Phosphore
- Sesquisulfure de phosphore
- Sélénium
- Sels de bismuth
- Sels de cadmium
- Sulfate de cuivre
- Tétraéthylplomb (plomb tétraéthyle)
- Thallium
- Uranium
- Vanadium
- etc.
Intoxications par les métaux lourds
[modifier | modifier le code]Le terme « métaux lourds » étant plus communément réservé aux :
- Cadmium (maladie Itai-itai)
- Chrome
- Cuivre
- Fer
- Mercure (hydrargyrie ou hydrargyrisme : maladie de Minamata)
- Nickel
- Palladium
- Plomb (saturnisme)
- Zinc
- Plutonium
- Strontium
- etc.
Intoxications médicamenteuses
[modifier | modifier le code]Intoxication par les gaz
[modifier | modifier le code]- Ammoniac
- Chlore
- Gaz lacrymogène
- Trihydrure d'arsenic (hydrogène arsénié)
- Sulfure d'hydrogène (hydrogène sulfuré)
- Intoxication au monoxyde de carbone
- Oxydes d'azote
- Phosgène
- etc.
Intoxication par les drogues
[modifier | modifier le code]Intoxication par les produits industriels
[modifier | modifier le code]- Acétone
- Acide acétique
- Acide borique
- Acide cyanhydrique
- Acide fluorhydrique
- Acides forts
- Acide oxalique
- Alcools :
- Amine aromatique
- Ammoniac
- Antigel - éthylène glycol
- Acide phosphorique - antirouille
- Bromures
- Bromométhane
- Cétones :
- Chlorates
- Chloronaphtalène
- Chlorure de vinyle
- Cyanures
- Cyclohexane
- Dérivés nitrés aromatiques
- Dinitrophénol
- Dioxines
- Esters : acétate d'éthyle
- Éthers : éther
- Éthers de glycol
- Fluoroacétate de sodium
- Formaldéhyde (formol)
- Hydrocarbures aromatiques polycycliques (HAP)
- Hexane
- Hydrazine
- Hydrocarbures aromatiques
- Hydrocarbures halogénés (chlorés, bromés, fluorés) :
- Isocyanates
- Mésitylène
- Métaldéhyde
- Naphtaline
- Nitrates
- Nitrites
- Nitrobenzène
- Paradichlorobenzène
- Pétrole et dérivés
- Phénols
- Polychlorobiphényle
- Pyralène
- Savons et détergents
- Solvants (voir ci-dessous)
Solvants
[modifier | modifier le code]Solvants pétroliers
Solvants divers
Les 21 toxiques chimiques industriels d'importance opérationnelle
[modifier | modifier le code]Cette liste de produits intéressant les armées en opération a été produite[52] par groupe de travail trinational[53], sur la base de 3 critères : 1) probabilité présence du produit sur un théâtre d'opérations militaires (particulièrement dans une zone industrielle), 2) la pression de vapeur (danger vapeur) et 3) la toxicité du produit. (liste adoptée par la France et inscrite dans l'AMedP6[54].
Toxines stoppées par les filtres de cartouches militaires classiques
[modifier | modifier le code]Toxine non arrêtés par la cartouche militaire
[modifier | modifier le code]Intoxications par les produits phytosanitaires
[modifier | modifier le code]Herbicides
[modifier | modifier le code]Fongicides
[modifier | modifier le code]Insecticides
[modifier | modifier le code]- Organochlorés
- Organophosphorés
- Carbamates
- Pyréthrinoïdes de synthèse
- Divers
- etc.
Intoxication par les produits à usage domestique
[modifier | modifier le code]- Détergents
- Eau de Javel
- Naphtalène (naphtaline)
- Hydroxyde de sodium (soude caustique)
- Solvants
- etc.
Intoxication par les poisons d'origine végétale
[modifier | modifier le code]Intoxication par les venins d'animaux
[modifier | modifier le code]Principales intoxications et tableaux cliniques rencontrés
[modifier | modifier le code]- Argyrisme : intoxication par l'argent
- Hydrargyrisme : intoxication par le mercure
- Intoxication au cadmium
- Intoxication au cyanure
- Saturnisme : intoxication par le plomb
Notes et références
[modifier | modifier le code]- ↑ « Les chamanes artistes de la préhistoire », LExpress.fr, (lire en ligne, consulté le )
- ↑ Dame blanche (peinture)
- ↑ (en) Elisa Guerra-Doce, « Psychoactive Substances in Prehistoric Times: Examining the Archaeological Evidence », Time and Mind, vol. 8, no 1, , p. 91-112 (ISSN 1751-696X, DOI 10.1080/1751696X.2014.993244, lire en ligne, consulté le )
- ↑ (es) Alec Forssmann, « Drogas y alcohol en la prehistoria europea », nationalgeographic.com.es, (lire en ligne, consulté le )
- ↑ (en) Kate Mosford, « Palaeolithic Poisons Analysis », sur chromatographyonline.com (consulté le )
- Gustave Lagneau, « De l'usage des flèches empoisonnées chez les anciens peuples de l'Europe », Comptes rendus des séances de l'Académie des Inscriptions et Belles-Lettres, vol. 21, no 4, , p. 342-350 (lire en ligne)
- Charles Buchet, « Histoire de la législation des substances vénéneuses », Bulletin de la Société d'histoire de la pharmacie, no 10 (36), , p. 105-111 (lire en ligne)
- ↑ (en) Gonzalo M. Sanchez et W. BensonHarer, « Chapter 1 - Toxicology in Ancient Egypt », dans History of Toxicology and Environmental Health, vol. 1 in Toxicology in Antiquity, Elsevier, (DOI 10.1016/B978-0-12-800045-8.00001-0), p. 1-10.
- (en) Ronit Haimov-Kochman, Yael Sciaky-Tamir, Arye Hurwitz, « Reproduction concepts and practices in ancient Egypt mirrored by modern medicine », European Journal of Obstetrics & Gynecology and Reproductive Biology, no 123, , p. 3-8 (lire en ligne)
- ↑ (en) Okasha A., « Mental disorders in pharaonic Egypt », Curare, no 16, , p. 66-70 (résumé)
- ↑ Michel Rosenzweig, Les drogues dans l'histoire entre remède et poison, De Boeck et Belin, (lire en ligne), p. 22
- ↑ Grmek M.D., « La légende et la réalité de la nocivité des fèves », History and Philosophy of the Life Science, vol. 2, no 1, , p. 61-121 (résumé)
- université Paris Descartes, Une histoire de la pharmacie. Remèdes, onguents, poisons, de La Martinière, , p. 166
- ↑ Jean Théodoridès, « Nicandre et les serpents », Revue d'histoire de la pharmacie, vol. 65, no 233, , p. 153 (lire en ligne)
- ↑ Irissou Louis, « Brève histoire de la Toxicologie », Revue d'histoire de la pharmacie, vol. 35, no 117, , p. 163-164 (lire en ligne)
- ↑ (en) W.T. Poon, « Laboratory Role in Toxicology: From Diagnostic to Theranostic », Topical update. The Hong Kong College of Pathologists, vol. 6, no 1, , p. 1-5 (lire en ligne [PDF])
- ↑ A. Ed. Chaignet, Vie de Socrate, Didier et Cie, (lire en ligne), p. 282.
- ↑ Philippe Marchenay, « Miels, miellats, miellées », Journ. d'Agric. Trad. et de Bota. Appl., no XXXV, , p. 121-146 (lire en ligne)
- Organisation mondiale de la santé, L'utilisation des pesticides en agriculture et ses conséquences pour la santé publique, (lire en ligne), p. 17.
- ↑ Paul Fabiani, « Joseph-Bienaimé Caventou », Revue d'histoire de la pharmacie, vol. 72, no 262, , p. 327-330 (lire en ligne)
- (en) vom Saal FS, Timms BG, Montano MM, Palanza P, Thayer KA, Nagel SC, Dhar MD, Ganjam VK, Parmigiani S, Welshons WV, « Prostate enlargement in mice due to fetal exposure to low doses of estradiol or diethylstilbestrol and opposite effects at high doses », Proc. Natl. Acad. Sci. USA, vol. 94, no 5, , p. 2056-61
- (en) Dan Fagin, « Toxicology: The learning curve », Nature, no 490,
- ↑ « Le bisphénol A peut-il être plus toxique à faible dose qu’à forte dose ? », sur Science étonnante, (consulté le )
- ↑ Novack G.D (1997). Ocular toxicology. Current opinion in ophthalmology, 8(6), 88-92.
- ↑ Luc de Haro, Les envenimations par les serpents de France et leur traitement, Presse Med, 2003;32:1131-7.
- ↑ (en) L. Ritter et T. E. Arbuckle ; « Can Exposure Characterization Explain Concurrence or Discordance between Toxicology and Epidemiology? » Toxicol Sci. 2007;97(2):241-252. (Résumé et article complet)
- ↑ Ramazzini Bernardino, Des maladies du travail, traduction Antoine de Fourcroy, Ayssènes, 1990 : Alexitères Éditions (1re édition, 1700).
- ↑ Thébaud-Mony A (2017) Science asservie et invisibilité des cancers professionnels : études de cas dans le secteur minier en France. Relations Industrielles/Industrial Relations, 72(1), 149-172.voir p 151
- ↑ Alison L. Jones et Paul I. Dargan, Toxicologie d'urgence, Belgique, Elsevier, , 163 p.
- ↑ Chantal Bismuth, Toxicologie clinique, Paris, Médecine-Sciences Flammarion, , 5e éd., 1092 p.
- E. Quemeneur, E. Lamazurier et M.T. Ménager, « La toxicologie : la multidisciplinarité au service de la sécurité sanitaire et environnementale », L'Actualité chimique, nos 367-368, , p. 17-23
- J.M. Scherrmann, « Pharmacocinétique de l'absorption digestive des toxiques en cas d'ingestion massive », Réan. Urg., vol. 2, no 2 bis, , p. 181-184
- Georges Houin, « Principes pharmacocinétiques de l'adaptation de la posologie : définitions et sources de variabilité », Revue Française des Laboratoires, , p. 25-31 (DOI 10.1016/S0338-9898(98)80152-2)
- S. Mouly, M. Morgand, A. Lopes, C. Lloret-Linares, J.F. Bergmann, « Interactions médicaments-aliments en médecine interne : quels messages pour le clinicien ? », La Revue de médecine interne, , p. 1-10 (lire en ligne)
- F. Marano, « Mécanismes d'action des particules atmosphériques fines et ultrafines », Pollution atmosphérique, , p. 20-23
- (en) Z. Liang, R Ni, J. Zhou, S. Mao, « Recent advances in controlled pulmonary drug delivery », Drug Discovery Today, vol. 20, no 3, , p. 380-389
- J.C. Amoric, « Absorption cutanée et accidents toxiques des traitements locaux chez l'enfant », Rev. Fr. Allergol. Immunol. Clin., no 40, , p. 747-753
- « Barrière cutanée-Absorption percutanée », Ann. Dermatol. Venereol., vol. 132, no 8 (suppl.), , S51-52
- ↑ F. Botta, A Albinet, E. Ughetto, E. Leoz Guarzandia, Origine des HAP dans les milieux aquatiques, France, ONEMA-INERIS, , 45 p. (lire en ligne), p. 11.
- ↑ C. Vauzelle, E. Elefant, P. Vert, « Médicaments et grossesse », Rev. Méd. Périnat., no 6, , p. 29-38
- ↑ chru-lille.fr: Magazine N°34 : Médicaments et grossesse
- INERIS, Point sur les valeurs toxicologiques de référence (Rapport d'étude), France, INERIS, , 60 p., pdf (lire en ligne)
- Expertise collective INSERM, Bisphénol A effets sur la reproduction Rapport préliminaire, France, INSERM, (lire en ligne), p. 1-90
- ↑ (en) « Clostridium botulinum », sur IPCS INCHEM, (consulté le )
- (en) « Strychnine », sur IPS INCHEM, (consulté le )
- ↑ Coumoul X (2015) Toxicologie et alimentation: nouveaux concepts. Cahiers de Nutrition et de Diététique, 50(6), 6S36-6S41.
- ↑ B.Pons, F. Vincent, F. Zeni, M. Darmon, « Insuffisance rénale aiguë : intérêt des nouveaux biomarqueurs », Réanimation, no 21, , p. 419-428 (lire en ligne)
- ↑ Daniel Le jeune (inspecteur général des affaires sociales) (2008), La traçabilité des expositions professionnelles I- Résumé et rapport (rapport remis à M. Franck Gambelli, président de la Commission des accidents du travail et des maladies professionnelles, en appui à cette commission, à la demande du ministre de la Santé Xavier Bertrand, octobre 2008, La documentation française, 180 p. [PDF]
- ↑ Exemple d'approche par modélisation inversée : Modélisation inverse pour l'optimisation des sources primaires de pollution atmosphérique à l'échelle régionale, par I Pison (2005), avec Archives-ouvertes
- ↑ (en) G.A. Alexander, U.K. Henschke, « Advanced skin cancer in tanzanian albinos : preliminary observations », Journal of the National Medical Association, no 73(11), , p. 1047-1054
- ↑ (en) Krishnan K, Brodeur J., « Toxicological consequences of combined exposure to environmental pollutants », Arch. Complex Environ. Stud., no 3(3), , p. 1-106.
- ↑ Beaume, Sébastien (20016) Prise en charge de victimes en ambiance chimique : concepts actuels et intérêts d’une médicalisation de l’avant Thèse (médecine des armées) ; faculté de médecine René-Descartes Paris-5 ; voir 4.5. Les toxiques industriels
- ↑ « International Task Force » (Canada, États-Unis et Royaume-Uni)
- ↑ AMedP6 volume III (tableau 17)
Voir aussi
[modifier | modifier le code]Articles connexes
[modifier | modifier le code]- Poison
- Dose létale
- Toxidrome
- Antidote
- Chélation
- Cancérogène, mutagène et reprotoxique (CMR)
- Tests médicaux rapides
- Phrases de risque (« phrases R »)
- Conseils de prudence (« phrases S »)
- Addictologie
- Mycotoxicologie
- Nanotoxicologie
- Liste de champignons toxiques
- Liste des fruits toxiques d'Europe
- Centre antipoison et de toxicovigilance
- Lait maternel humain
- Santé-environnement
- Numéro ORFILA
Liens externes
[modifier | modifier le code]
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- « TOXNET - Your resource for searching databases on toxicology, hazardous chemicals, environmental health, and toxic releases », sur toxnet.nlm.nih.gov (consulté le )
- Base « Fiches toxicologiques » de l'INRS, Institut National de Recherche et de Sécurité (consulté le )
- INERIS
- Toxalim
Bibliographie
[modifier | modifier le code]- (en) Calabrese, E.J. et Baldwin, L.A. (2003), Toxicology rethinks its central belief, Nature, 421(6924), 691-692.
- (en) Eaton DL, Gilbert SG. Principles of toxicology. In: Klaassen CD, ed. Casarett & Doull’s toxicology: the basic science of poisons. New York: McGraw-Hill, 2013:13-48.
 KSF
KSF





